 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
RESOLUCIÓN 1862 DE 2023
(noviembre 15)
Diario Oficial No. 52.580 de 15 de noviembre de 2023
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
Por la cual se modifica el artículo 1o de la Resolución número 986 de 2023, en virtud de la cual se establecieron los lineamientos para la aplicación de las vacunas contra la COVID-19, y se dictan otras disposiciones.
EL MINISTRO DE SALUD Y PROTECCIÓN SOCIAL,
en ejercicio de sus facultades, especialmente las conferidas por el literal b) del artículo 488 de la Ley 9 de 1979, los numerales 3 del artículo 173 de la Ley 100 de 1993, 42.1 del artículo 42 de la Ley 715 de 2001, 3, 4 y 9 del artículo 2o del Decreto Ley 4107 de 2011 y 19.1 del artículo 19, el artículo 6o del Decreto número 109 de 2021 y en desarrollo del parágrafo del artículo 9o de la Ley 2064 de 2020, y
CONSIDERANDO:
Que el Ministerio de Salud y Protección Social expidió la Resolución número 986 del 21 de junio de 2023, en virtud de la cual se establecieron los lineamientos para la aplicación de las vacunas contra la COVID-19, y en el numeral 4.1 de su Anexo 1o, estableció el esquema de vacunación primario, incluyendo la vacunación con SpikevaxCOVID-19 Vaccine para niños de 6 meses a 2 años.
Que, el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) mediante la Resolución número 2023001963 de 19 de enero de 2023, modificó la Resolución número 2022019162 del 24 de junio de 2022, que concedió la Autorización de Uso de Emergencia número ASUE 2022-000005-R1, para SPIKEVAX COVID-19 VACCINE MODERNA, a favor de la sociedad MODERNA SWITZERLAND GmbH, en el sentido de aprobar el uso en la población pediátrica mayor a 6 meses, dado que contaba con los estudios respectivos, la evidencia de perfil de seguridad, eficacia y efectividad, así mismo, autorizó nueva dosificación, precauciones y advertencias, reacciones adversas e inserto.
Que la Parte 1 del estudio P204, citado en la referida Resolución número 2023001963 de 2023, señala que la dosis que permite una adecuada respuesta de anticuerpos sin incrementar los efectos adversos relacionados con la reactogenicidad, en población de 6 meses a 5 años son 2 (dos) dosis de 25 microgramos (0,25 ml cada una, que contiene 25 microgramos ARNm y para la población de 6 a 11 años son 2 dos) dosis de 50 microgramos (0.5 ml cada una, que contiene 50 microgramos de ARNm.
Que el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) mediante la Resolución número 2023029356 de 30 de Junio de 2023, resolvió: “CONCEDER LA AUTORIZACIÓN SANITARIA DE USO DE EMERGENCIA (ASUE), por una (1) sola vez, por el término de un (1) año a: PRODUCTO: SPIKEVAX BIVALENT ORIGINAL/ OMICRON BA.4/BA.5 (50MICROGRAMOS/50 MICROGRAMOS) /ML COMPOSICIÓN: Cada dosis (0,5 mL) contiene 25 microgramos de elasomerán y 25 microgramos de devasomerán, una vacuna de ARNm frente a la COVID-19 (encapsulado en nanopartículas lipídicas SM-102). Elasomerán es un ARN mensajero (ARNm) monocatenario con caperuza en el extremo 5' producido mediante transcripción in vitro acelular a partir de los moldes de ADN correspondientes, que codifica la proteína de la espícula (S) viral del SARS-CoV-2 (Original). Davesomerán es un ARN mensajero (ARNm) monocatenario con caperuza en el extremo 5', fabricado mediante transcripción in vitro sin células a partir de las plantillas de ADN correspondientes, que codifican la proteína de la espícula (S) del SARS-Cov-2 (variante ómicron BA.4-5). Las proteínas S de los linajes BA.4 y BA.5 de la variante ómicron del SARS CoV-2 son idénticas”.
Que, la forma farmacéutica de la vacuna Spikevax bivalent® Original/Ómicron BA.4-5 es Suspensión inyectable. Presentación comercial: Caja con 10 viales multidosis. 5 dosis de 0,5 mL cada una. Cada vial contiene 2,5 mL de suspensión en una vial multidosis, está indicada para la inmunización activa para prevenir la COVID-19, causada por el virus SARS-CoV-2, en grupos poblaciones con alto riesgo de complicaciones de 18 años de edad y mayores que han recibido previamente al menos la primera vacunación frente a la COVID-19.
Que, el Comité Asesor del Ministerio de Salud y Protección Social para el proceso estratégico de inmunización de la población colombiana frente a la COVID-19, en su sesión número 78 realizada el día 7 de septiembre de 2023, y ante los resultados presentados de coberturas de vacunación en población de 6 meses a 2 años, decide ampliar la vacunación con MODERNA SWITZERLAND GmbH a niños de 3 a 5 años y a niños de 6 a 11 años.
Que, es posible la coadministración de los biológicos contra la COVID con todos los biológicos del Programa Ampliado de Inmunización (PAI) de manera simultánea o con cualquier intervalo de tiempo, de acuerdo con lo señalado por el referido Comité Asesor en su sesión número 77, el Comité Nacional de Practicas de Inmunización (CNPI), en decisión del pasado 31 de julio, así como las revisiones y recomendaciones de expertos, sociedades científicas y académicas como la Sociedad Colombiana de Pediatría (SCP), Asociación Colombiana de Infectología ACIN, entre otras.
Que desde el mes de septiembre de 2023 el país no cuenta con la vacuna de Janssen en su portafolio, toda vez que el laboratorio Janssen no renovó la Autorización Sanitaria de Uso de Emergencia ASUE para continuar con la comercialización de esta vacuna en el país.
Que a la luz de lo anterior, se hace indispensable modificar el artículo 1o de la Resolución número 986 del 21 de junio de 2023, en virtud de la cual se establecieron los lineamientos para la aplicación de las vacunas contra la COVID-19, así como algunos de los lineamientos contenidos en sus anexos técnicos; asimismo, sustituir el Anexo técnico para la aplicación de la vacuna Moderna ARNm-1273, Switzerland GmbH contra la COVID-19, en aras de garantizar la protección del derecho a la salud y a la vida de los habitantes del territorio nacional.
En mérito de lo expuesto,
RESUELVE:
ARTÍCULO 1o. Modificar el artículo 1o de la Resolución número 986 del 21 de junio de 2023, el cual quedará así:
“Artículo 1o. Objeto. La presente resolución tiene por objeto establecer los lineamientos para la vacunación contra la COVID-19 contenidos en los siguientes anexos técnicos, los cuales hacen parte integral de la presente resolución:
Anexo 1o. Lineamientos técnicos y operativos para la vacunación contra la COVID-19.
Anexo 2o. Consentimiento informado para la aplicación de la vacuna contra el SARS-CoV-2/ COVID-19.
Anexo 3o. Anexo técnico para la aplicación de la vacuna BNT162b2 Pfizer-BioNTech contra la COVID-19.
Anexo 4o. Anexo técnico para la aplicación de la vacuna Sinovac Life Scienses Co Ltd denominada CoronaVac contra la COVID-19.
Anexo 5o. Anexo Técnico Para La Aplicación de La Vacuna Moderna Arnm, Contra La COVID-19”.
ARTÍCULO 2o. Modificar el numeral 3 del Anexo 1o denominado “Lineamientos Técnicos Y Operativos para la Vacunación Contra la COVID 19” de la Resolución número 986 del 21 de junio de 2023, el cual quedará así:
“3. VACUNAS CONTRA LA COVID-19
Las vacunas contra la COVID-19 de diferentes plataformas que actualmente se encuentran en el país, son:
| Vacuna | Fabricante | Plataforma |
| Pfizer | BNT1062B2 Pfizer Inc y BioNTech | ARN mensajero |
| Sinovac | Sinovac Life Scienses Co Ltd denominada CoronaVac | Virus inactivado |
| Moderna Pediátrica: “SpikevaxCOVID-19 Vaccine Moderna” | MODERNA SWITZERLAND GMBH | ARN mensajero |
| Moderna Bivalente: “Spikevax Bivalent Original/Omicron BA.4-5” | ||
Estas vacunas cuentan con especificaciones técnicas e indicaciones particulares, las cuales deben ser revisadas en los anexos técnicos 3, 4 y 5 del artículo primero de la presente resolución.
ARTÍCULO 3o. Modificar los numerales 4.1, 4.2 y 4.3 del Anexo 1o denominado “LINEAMIENTOS TÉCNICOS Y OPERATIVOS PARA LA VACUNACIÓN CONTRA LA COVID 19” de la Resolución número 986 del 21 de junio de 2023, los cuales quedarán así:
“4.1 Esquema de vacunación primario”
El esquema primario de vacunación consta de la aplicación de dos dosis a la población en general según el siguiente cuadro:
| Edad de aplicación | Primera dosis | Segunda dosis | Plataforma |
| 6 meses a 2 años | Moderna Pediátrica ARNm-, SpikevaxCOVID-19 Vaccine Moderna* | Moderna Pediátrica ARNm-, SpikevaxCOVID-19 Vaccine Moderna* | Homóloga |
| 3 a 5 años | Sinovac Life Scienses Co Ltd denominada CoronaVac | Sinovac Life Scienses Co Ltd denominada CoronaVac | Homóloga |
| Moderna Pediátrica ARNm-, SpikevaxCOVID-19 Vaccine Moderna* | Moderna Pediátrica ARNm-, SpikevaxCOVID-19 Vaccine Moderna* | Homóloga | |
| 6 a 11 años | Sinovac Life Scienses Co Ltd denominada CoronaVac | Sinovac Life Scienses Co Ltd denominada CoronaVac | Homóloga |
| Moderna Pediátrica ARNm-, SpikevaxCOVID-19 Vaccine Moderna* | Moderna Pediátrica ARNm-, SpikevaxCOVID-19 Vaccine Moderna* | Homóloga | |
| 12 a 17 años | Vacuna plataforma ARNm | Vacuna plataforma ARNm | Homóloga |
| Sinovac Life Scienses Co Ltd denominada CoronaVac | Sinovac Life Scienses Co Ltd denominada CoronaVac | Homóloga | |
| 18 años y más | Sinovac Life Scienses Co Ltd denominada CoronaVac | Sinovac Life Scienses Co Ltd denominada CoronaVac | Homóloga |
| Vacuna plataforma ARNm | Heteróloga | ||
| Vacuna plataforma ARNm | Vacuna plataforma ARNm | Homóloga - Heteróloga | |
* La administración de vacuna Moderna Pediátrica ARNm. SpikevaxCOVID-19 Vaccine Moderna, en niños de 6 meses a 5 años se realizará en una serie de dos (2) dosis de 25 microgramos cada una (0,25 ml cada una) con un intervalo de 28 días entre las dos dosis. Para la población de 6 a 11 años se realizará una serie de 2 (dos) dosis de 50 microgramos cada una (0.5 ml cada una) con un intervalo de 28 días entre las dos dosis.
4.2 Aplicación de dosis adicional para personas mayores de 12 años
Las personas de 12 a 17 años después de haber completado el esquema primario, podrán acceder a dosis adicional con vacuna de ARNm posterior a los seis (6) meses de haber recibido la última dosis; de acuerdo con la disponibilidad de vacuna en el país y a las indicaciones del fabricante.
Población de 18 años y más accederá a dosis adicional al menos seis (6) meses después de la última dosis contra la COVID-19, con la vacuna ARNm; de acuerdo a la disponibilidad de vacuna en el país y a las indicaciones del fabricante.
4.3 Grupos priorizados para dosis adicional
Teniendo en cuenta que la pandemia por la COVID-19 continua y según recomendación de la OMS es necesario para la aplicación de dosis adicional priorizar los siguientes grupos de riesgo, así:
Gestantes: la dosis adicional se debe administrar cuando hayan pasado 6 meses de su esquema de vacunación (Esquema primario y/o refuerzos). Se debe garantizar una dosis por cada embarazo.
Mayores de 60 años: la dosis adicional se debe administrar después que hayan pasado al menos 6 meses de su esquema de vacunación (Esquema primario y/o refuerzos).
Población con comorbilidades: la población con comorbilidades debe recibir una dosis adicional al menos 6 meses luego de su última dosis.
Talento Humano de Salud: la dosis adicional se debe administrar después que hayan pasado al menos 6 meses de su esquema de vacunación (Esquema primario y/o refuerzos).
Para las gestantes la dosis adicional debe ser de ARNm Pfizer.
Para los otros 3 grupos priorizados la dosis adicional debe ser de la plataforma ARNm; de acuerdo con la disponibilidad de vacuna en el país y a las indicaciones del fabricante.
Nota 1. Si una persona mayor de 18 años fue vacunada con Janssen debe recibir una dosis de vacuna de ARNm mínimo 6 meses después de la inicial.
Nota 2. Se pueden coadministrar todos los biológicos contra la COVID-19 con todos los biológicos del Programa Ampliado de Inmunización de manera simultánea o con cualquier intervalo de tiempo.
Nota 3. La vacuna moderna bivalente, Spikevax bivalent® Original/Ómicron BA.4- 5 está indicada para la inmunización activa para prevenir la COVID-19, causada por el virus SARS-CoV-2, en grupos poblaciones con alto riesgo de complicaciones de 18 años y mayores que han recibido previamente al menos la primo vacunación frente a la COVID- 19.
ARTÍCULO 4o. Sustitúyase el anexo técnico para la aplicación de la vacuna Moderna ARNm-1273, Switzerland GmbH contra la COVID-19, contenido en la Resolución número 986 del 21 de junio de 2023, por el que se adjunta al presente acto administrativo, el cual hará parte integral del mismo.
ARTÍCULO 5o. VIGENCIA. El presente acto administrativo rige a partir de su expedición y deroga las disposiciones que le sean contrarias.
PUBLÍQUESE Y CÚMPLASE.
Dada en Bogotá, D. C., a 15 de noviembre de 2023.
El Ministro de Salud y Protección Social,
GUILLERMO ALFONSO JARAMILLO MARTÍNEZ.
ANEXO 5
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA MODERNA ARNM, CONTRA LA COVID-19
Generalidades de la vacuna
La vacuna elaborada por Switzerland GMBH contra la COVID-19 denominada Moderna ARNm-Switzerland GmbH es ARN mensajero monocatenario producido mediante transcripción in vitro acelular, que codifica la proteína de la espícula (S) viral del SARS-CoV-2.
La vacuna estimula las defensas naturales (sistema inmunitario) y funciona haciendo que el organismo genere protección (anticuerpos) contra el virus que causa la COVID-19. Utiliza el ARNm para transportar las instrucciones con las cuales las células producen la proteína de espículas que se encuentran en el virus. Luego, las células del sistema inmunitario son estimuladas para fabricar anticuerpos contra la proteína de las espículas para luchar contra el virus y proteger a la persona vacunada contra la COVID-19 (1).La vacuna contiene los siguientes excipientes: lípido SM- 102, colesterol, 1,2-diestearoil-sn-glicero-3-fosfocolina (DSPC), 1,2-dimiristoil-rac-glicero-3-metoxipolietilenglicol-2000 (PEG2000 DMG), trometamol, clorhidrato de trometamol, ácido acético, acetato de sodio trihidrato, sacarosa, agua para preparaciones inyectables.
1. MODERNA PEDIÁTRICA - SPIKEVAX COVID-19 VACCINE MODERNA
1. Presentación, forma farmacéutica e indicación terapéutica
1.1. Presentación
- Adición de la presentación comercial: caja de cartón con 10 viales multiuso donde cada vial contiene 5 dosis de 0.5 ml / 10 dosis de 0.25 ml.
- Artes para la presentación comercial: caja de cartón con 10 viales multiuso.
1.2. Forma farmacéutica
- Suspensión inyectable.
- La vacuna es un líquido de color blanco o blanquecino (pH: 7,0 - 8,0) tanto en el vial como en la jeringa.
1.3. Indicaciones terapéuticas
- Spikevax está indicada para la inmunización activa para prevenir la COVID-19, causada por el virus SARS-CoV-2, en personas de 6 meses de edad en adelante. Esta vacuna debe utilizarse conforme a las recomendaciones del fabricante.
2. Conservación:
Periodo de validez
- Vial sin abrir

- Vial perforado

3. Seguridad, inmunogenicidad y eficacia
Los estudios de seguridad e inmunogenicidad de la dosis de 25 íg de vacuna moderna en niños fueron evaluados en 3040 niños de 2 a 5 años y 1762 se asignó aleatoriamente a niños de 6 a 23 meses de edad, al recibir dos inyecciones de 25 íg de ARNm- (Moderna pediátrica); 1008 niños de 2 a 5 años y 593 niños de 6 a 23 meses de edad fueron asignados aleatoriamente y recibieron placebo. La duración media del seguimiento después de la segunda inyección fue de 71 días en la cohorte de 2 a 5 años y 68 días en la cohorte de 6 a 23 meses.
Los eventos adversos encontrados fueron principalmente de bajo grado y transitorios y no se identificaron nuevos problemas de seguridad. Al día 57, las concentraciones de medias geométricas de anticuerpos neutralizantes fueron 1410 (intervalo de confianza [IC] del 95%, 1272 a 1563) entre niños de 2 a 5 años y 1781 (IC del 95%, 1616 a 1962) entre de 6 a 23 meses, en comparación con 1.391 (IC del 95 %, 1.263 a 1.531) entre los jóvenes adultos, que habían recibido inyecciones de 100 íg de ARNm-, hallazgos que cumplían con los criterios de no inferioridad para las respuestas inmunes para ambas cohortes de edad.
El estimado de la eficacia de la vacuna contra COVID-19 en niños entre 2 a 5 años fue del 36,8% (IC del 95%, 12,5 a 54,0) y el 50,6% (IC del 95%, 21,4 a 68,6) entre los niños de 6 a 23 meses, en un momento cuando B.1.1.529 (Ómicron) era la variante circulante predominante.
Se evidenció que dos dosis de 25 íg de la vacuna mRNA- son seguras y eficaces en niños de 6 meses a 5 años y generan respuestas inmunes que no fueron inferiores a los de adultos jóvenes.
4. Dosis, vía y sitio de administración
4.1. Dosis, vía y sitio de administración en niños de 6 meses a 5 años
| Concentración | Volumen total | Dosis | Número de dosis por vial | Composición de la vacuna |
| 0.1 mg/ml | 2.5 ml | 0,25 ml o 25 mcg | 10 | 25 mcg de la cepa original o ancestral |
Una dosis (0,25 ml) contiene 25 microgramos de elasomerán, una vacuna de ARN mensajero frente a COVID-19 (encapsulado en nanopartículas lipídicas).
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0,25 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho, Para uso pediátrico en no caminadores se aplica en cara anterolateral del muslo. |
| 2ª dosis (28 días después de aplicada la primera dosis) | |||
4.2 Dosis, vía y sitio de administración en niños de 6 a 11 años
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. |
| 2ª dosis (28 días después de aplicada la primera dosis) |
4.3. Dosis, vía y sitio de administración en personas de 12 años y mayores
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. |
| 2ª dosis (28 días después de aplicada la primera dosis) |
Nota No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
5 Administración
- La serie de vacunas de Moderna Pediátrica ARNm - SpikevaxCOVID-19 Vaccine Moderna en niños de 6 meses a 5 años consta de dos dosis administradas por vía intramuscular cada una de 0,25 ml.
- La serie de vacunas de Moderna ARNm- en niños de 6 a 11 años consta de dos dosis administradas por vía intramuscular cada una de 0,5 ml.
- La serie de vacunas de Moderna ARNm- en personas mayores de 12 años consta de dos dosis administradas por vía intramuscular cada una de 0,5 ml.
- La población se aplicará la segunda dosis con un intervalo de 28 días y no antes; sin embargo, las segundas dosis administradas dentro de un período de gracia de 4 días antes de la fecha recomendada para la segunda dosis aún se consideran válidas.
- Para refuerzos en mayores de 18 años la dosis es de 0.5 ml.
- La vacuna no debe mezclarse en la misma jeringa con otras vacunas u otros medicamentos.
5.1 Coadministración con otras vacunas
Se puede aplicar la coadministración de todos los biológicos contra la COVID-19 con todos los biológicos del programa permanente de manera simultánea o con cualquier intervalo de tiempo.
5.2 Preparación de la vacuna
5.2.1 Procedimiento para la descongelación de la vacuna
- El vial multidosis se almacena congelado y debe descongelarse antes de su uso.
- La caja térmica de Moderna ARN-m contiene 10 viales multidosis de vacuna congelados (10 dosis cada uno).
- Una vez abierta, descongelar los viales introduciéndolos al refrigerador para descongelarlos a una temperatura de +2 oC a +8 oC, alrededor de 2 horas y 30 minutos o dejar el vial 1 hora a temperatura ambiente (entre 15 oC y 25 oC).
- Antes de administrar la vacuna dejar el vial a temperatura ambiente durante 15 minutos y marcar el vial con la fecha y hora de descongelación (Nota: NO descongelar los viales desde el día anterior).
5.2.2 Procedimiento para la administración de la vacuna
- La vacuna debe ser administrada por un profesional sanitario mediante técnicas asépticas para garantizar la esterilidad del procedimiento.
- Inicialmente realice lavado o higiene de manos.
- La vacuna está lista para usarse una vez descongelada.
- Verifique que el líquido tiene un color blanco o blanquecino tanto en el vial como en la jeringa.
- La vacuna puede contener partículas blancas o transparentes relacionadas con el producto.
- Gire el vial suavemente después de la descongelación y antes de cada extracción. No agitar ni sacudir.
- Una vez descongelado el vial de la vacuna se pueden extraer diez (10) dosis (de 0,25 ml cada una).
- Una vez descongelado el vial de la vacuna NO volver a congelar.
- Extraiga la dosis de 0,5 ml de vacuna con una aguja y una jeringa estériles de 1 ml (22G o 23G) convencional o auto descartable según disponibilidad y deseche cualquier vacuna no utilizada dentro de las 19 horas posteriores a la extracción de la primera dosis.
- Si la dosis es incorrecta, o hay un cambio de color y otras partículas presentes, no se debe administrar la vacuna.
- Se incluye un sobrellenado adicional en cada vial para garantizar que puedan administrarse 10 dosis de 0,5 ml. No acumule el exceso de vacuna de múltiples viales.
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante, si es así siga el siguiente flujo de información:
1. Reporte al coordinador del punto de vacunación su hallazgo.
2. No utilice el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal por correo electrónico, indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal, departamental o distrital.
6. El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin.
7 Este Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
8 Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
- Al finalizar la jornada diaria se deben identificar las dosis sobrantes por inasistencia de personas a las citas o disminución del cálculo de la pérdida por frasco abierto.
- Posteriormente, identificar la población que no se encuentre vacunada y aplicar la vacuna priorizando de acuerdo con los grupos poblacionales de 6 meses a 11 años.
- Es importante mencionar que todas las personas a vacunar estén agendadas o no, deben seguir todo el proceso de vacunación, que incluye entre otros, diligenciar y firmar el consentimiento informado, recibir la información relacionada con la vacuna, permanecer el tiempo asignado en las instalaciones posterior a la vacunación según su condición, registrar la información en el PAIWEB y recibir el carné de vacunas.
5.3 Técnica para aplicar la vacuna
- Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. Para uso pediátrico en no caminadores se aplica en cara anterolateral del muslo.
- Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
- Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
- Con una mano estire la piel con los dedos pulgar e índice.
- Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90o sobre el plano de la piel.
- Introduzca la aguja por vía intramuscular.
- Presione el émbolo para que penetre la vacuna.
- Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
- Estire la piel para perder la luz del orificio que dejó la aguja.
- Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
6 Contraindicaciones
- Hipersensibilidad al principio activo o a alguno de los excipientes.
7. Advertencias y precauciones
Trazabilidad. Con el objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
Hipersensibilidad y anafilaxia. Se han notificado casos de anafilaxia en personas que han recibido Spikevax. Siempre debe haber fácilmente disponibles el tratamiento y la supervisión médica adecuada en caso de que se produzca una reacción anafiláctica tras la administración de la vacuna. Se recomienda una observación estrecha durante al menos 15 minutos tras la vacunación. No se deben administrar las dosis posteriores de la vacuna a las personas que hayan experimentado anafilaxia con una dosis anterior de Spikevax.
Miocarditis y pericarditis. Existe un mayor riesgo de miocarditis y pericarditis tras la vacunación con Spikevax. Estos trastornos pueden aparecer a los pocos días de la vacunación y se produjeron principalmente en un plazo de 14. Se han observado con mayor frecuencia tras la segunda dosis de la vacunación, y con mayor frecuencia en varones jóvenes (ver sección 4.8). Los datos disponibles indican que el curso de la miocarditis y la pericarditis tras la vacunación no es diferente del curso de la miocarditis o la pericarditis en general. Los profesionales de la salud deben estar atentos a los signos y síntomas de la miocarditis y la pericarditis. Se debe indicar a los vacunados que acudan inmediatamente a un médico si presentan síntomas indicativos de miocarditis o pericarditis, como dolor torácico (agudo y persistente), dificultad para respirar o palpitaciones después de la vacunación. Los profesionales de la salud deben consultar directrices o especialistas para diagnosticar y tratar esta enfermedad. Aún no se ha caracterizado el riesgo de miocarditis tras una tercera dosis o dosis de refuerzo de Spikevax.
Reacciones relacionadas con ansiedad. Se pueden producir reacciones relacionadas con ansiedad, incluidas reacciones vasovagales (síncope), hiperventilación o reacciones relacionadas con estrés, asociadas al acto vacunal como respuesta psicógena a la inyección con aguja. Es importante tomar precauciones para evitar lesiones a causa de un desmayo.
Enfermedad concomitante. La vacunación se debe posponer en personas que presenten una enfermedad febril aguda grave o una infección aguda. La presencia de una infección leve o de fiebre de baja intensidad no debe posponer la vacunación.
Trombocitopenia y trastornos de la coagulación. Como sucede con otras inyecciones intramusculares, la vacuna debe administrarse con precaución a las personas que reciban tratamiento anticoagulante o a aquellas que presenten trombocitopenia o padezcan un trastorno de la coagulación (como hemofilia) debido a que en estas personas se puede producir sangrado o formación de hematomas tras una administración intramuscular.
Exacerbaciones del síndrome de extravasación capilar. Se han notificado algunos casos de exacerbación del síndrome de extravasación capilar en los primeros días después de la vacunación con Spikeva x. Los profesionales sanitarios deben ser conscientes de los signos y síntomas de síndrome de extravasación capilar para reconocer y tratar rápidamente el trastorno. En personas con antecedentes médicos de síndrome de extravasación capilar, la vacunación debe planificarse en colaboración con los expertos médicos pertinentes.
Personas inmunocomprometidas. No se han evaluado la eficacia y la seguridad de la vacuna en personas inmunocomprometidas, incluidas aquellas que estén recibiendo tratamiento inmunosupresor. La eficacia de Spikevax puede ser menor en personas inmunocomprometidas. La recomendación de considerar una tercera dosis en personas gravemente inmunocomprometidas se basa en la evidencia serológica limitada con pacientes inmunocomprometidos tras un trasplante de órgano sólido.
Duración de la protección
Se desconoce la duración de la protección proporcionada por la vacuna, ya que todavía se está determinando en ensayos clínicos en curso.
Limitaciones de efectividad de la vacuna
Las personas pueden no estar totalmente protegidas hasta 14 días después de la segunda dosis. Como con cualquier vacuna, la vacunación con Spikevax puede no proteger a todas las personas que la reciban.
Excipientes con efecto conocido Sodio. Esta vacuna contiene menos de 1 mmol de sodio (23 mg) por dosis de 0,5 ml; es decir, esencialmente “exenta de sodio”.
Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
Las personas con COVID-19 aguda confirmada por PCR no deben vacunarse hasta que se hayan recuperado de la enfermedad aguda.
7.1 Reacciones adversas esperadas
Niños de 6 a 11 años
Los datos de seguridad de Spikevax en niños se recopilaron en un estudio clínico en curso de fase 2/3 de dos partes, aleatorizado y con enmascaramiento del observador realizado en Estados Unidos y Canadá (NCT04796896).
La parte 1 fue una fase abierta del ensayo sobre seguridad, selección de la dosis e inmunogenia, y en ella se incluyeron a 380 participantes de 6 a 11 años que recibieron al menos 1 dosis (0,25 ml) de Spikevax.
La parte 2 es la fase controlada con placebo para estudiar la seguridad e incluyó a 4016 participantes de 6 a 11 años que recibieron al menos una dosis (0,25 ml) de Spikevax (n=3,012) o placebo (n=1,004).
Ninguno de los participantes de la parte 1 participó en la parte 2. Las características demográficas fueron similares entre los participantes que recibieron Spikevax y los que recibieron placebo.
Las reacciones adversas más frecuentes de los participantes de 6 a 11 años después de la administración de la pauta inicial de vacunación fueron dolor en el lugar de la inyección (98,4%), fatiga (73,1%), cefalea (62,1%), mialgia (35,3%), escalofríos (34,6%), náuseas/vómitos (29,3%), hinchazón/sensibilidad axilar (27,0%), fiebre (25,7%), eritema en el lugar de la inyección (24,0%), hinchazón en el lugar de la inyección (22,3%) y artralgia (21,3%).
Niños de 6 meses a 5 años
En Estados Unidos y Canadá se llevó a cabo un estudio en curso en fase 2/3, aleatorizado, controlado con placebo, con enmascaramiento del observador para evaluar la seguridad, tolerabilidad, reactogenia y eficacia de Spikevax.
Este estudio contó con la participación de 10 390 personas de 6 meses a 11 años que recibieron al menos una dosis de Spikevax (n=7798) o placebo (n=2592). El estudio incluyó a niños en 3 grupos etarios: de 6 a 11 años; de 2 a 5 años; y de 6 a 23 meses.
En este estudio pediátrico participaron 6388 personas de 6 meses a 5 años que recibieron al menos una dosis de Spikevax (n=4791) o placebo (n=1597). Las características demográficas fueron similares entre los participantes que recibieron Spikevax y los que recibieron el placebo.
En este estudio clínico, las reacciones adversas en los participantes de 6 a 23 meses después de la administración de la pauta inicial fueron irritabilidad/llanto (81,5%), dolor en el lugar de la inyección (56,2%), somnolencia (51,1%), pérdida del apetito (45,7%), fiebre (21,8%), hinchazón en el lugar de la inyección (18,4%), eritema en el lugar de la inyección (17,9%) e hinchazón/ sensibilidad axilar (12,2%).
En un estudio clínico, las reacciones adversas en participantes de 24 a 36 meses después de la administración de la pauta inicial fueron dolor en el lugar de la inyección (76,8%), irritabilidad/ llanto (71,0%), somnolencia (49,7%), pérdida del apetito (42,4%), fiebre (26,1%), eritema en el lugar de la 8 inyección (17,9%), hinchazón en el lugar de la inyección (15,7%) e hinchazón/ sensibilidad axilar (11,5%).
En un estudio clínico, las reacciones adversas en los participantes de 37 meses a 5 años después de la administración de la pauta inicial fueron dolor en el lugar de la inyección (83,8%), fatiga (61,9%), cefalea (22,9%), mialgia (22,1%), fiebre (20,9%), escalofríos (16,8%), náuseas/ vómitos (15,2%), hinchazón/sensibilidad axilar (14,3%), artralgia (12,8%) en el lugar de la inyección (9,5%) e hinchazón en el lugar de la inyección (8,2%).
Tabla de reacciones adversas de estudios clínicos y de la experiencia posterior a la autorización en niños y personas de 6 meses en adelante.
El perfil de seguridad que se presenta a continuación se basa en los datos generados en varios estudios clínicos controlados con placebo:
- En 30 351 adultos =18 años,
- 3726 adolescentes de 12 a 17 años,
- 4002 niños de 6 a 11 años,
- 6388 niños de 6 meses a 5 años
- y la experiencia posterior a la comercialización.
Las reacciones adversas notificadas se enumeran de acuerdo con las categorías de frecuencia siguientes:
Muy frecuentes (=1/10)
Frecuentes (de =1/100 a <1/10)
Poco frecuentes (de =1/1000 a <1/100)
Raras (de =1/10 000 a <1/1000)
Muy raras (<1/10 000)
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Las reacciones adversas se presentan por orden decreciente de gravedad dentro de cada intervalo de frecuencia (tabla 2).
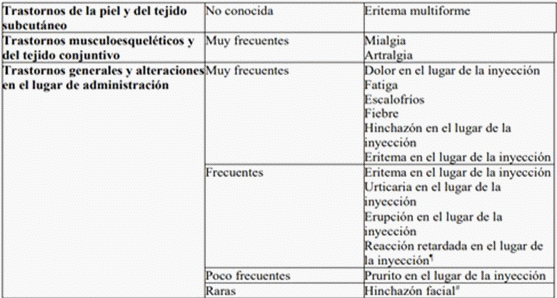
Tabla 2. Reacciones adversas de estudios clínicos de Spikevax y de la experiencia posterior a la autorización en niños y en personas de 6 meses en adelante
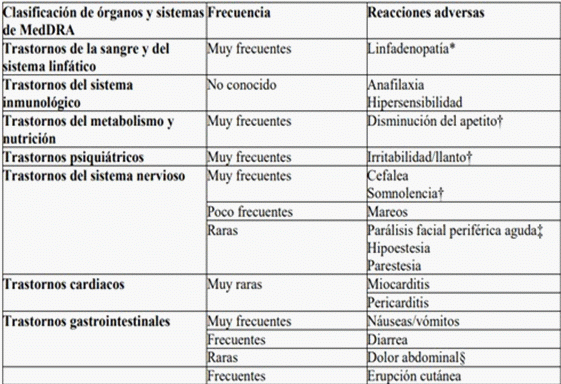
* La linfadenopatía fue registrada como linfadenopatía axilar en el mismo lado del lugar de la inyección. En algunos casos se vieron afectados otros ganglios linfáticos (p. ej., cervicales, supraclaviculares).
† Observado en la población pediátrica (de 6 meses a 5 años de edad).
‡ A lo largo del periodo de seguimiento de seguridad, se notificó parálisis facial periférica aguda en tres participantes del grupo de Spikevax y un participante del grupo de placebo. El momento de aparición en los participantes del grupo de la vacuna fue a los 22 días, 28 días y 32 días después de la dosis 2.
§ Se observó dolor abdominal en la población pediátrica (de 5 a 11 años de edad): un 0,2 % en el grupo de Spikevax y un 0 % en el grupo del placebo.
¶ La mediana del tiempo transcurrido hasta la aparición fue de 9 días después de la primera inyección, y de 11 días después de la segunda inyección. La mediana de duración fue de 4 días después de la primera inyección, y de 4 días después de la segunda inyección.
# Hubo dos acontecimientos adversos graves de hinchazón facial en los receptores de la vacuna con antecedentes de inyección de rellenos dermatológicos. La aparición de la hinchazón se notificó en el día 1 y día 3, respectivamente, en relación con el día de la vacunación.
La reactogenia y el perfil de seguridad en 343 sujetos que recibieron Spikevax, que eran seropositivos para el SARS-CoV-2 al inicio, fue comparable a la de los sujetos seronegativos para el SARS-CoV-2 al inicio.
8 Vacunación segura
Antes de recibir la vacuna Moderna ARNm debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si:
- Tiene alguna alergia. Es importante indagar al usuario si ha presentado reacción alérgica grave
- Si alguna vez se ha desmayado después de una inyección con aguja
- Tiene fiebre
- Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre)
- Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer)
- Ha recibido otra vacuna contra la COVID-19
Nota: ver Inserto de la vacuna y Resolución 2023001963 de 19 de enero de 2023
2. VACUNA MODERNA BIVALENTE ADULTO - SPIKEVAX BIVALENTE ORIGINAL/OMICRON BA.4-5
1. Generalidades de la vacuna
1.1. Spikevax bivalente Original/Omicron BA.4-5 qué es y para qué se utiliza
Spikevax bivalent Original/Omicron BA.4-5 es una vacuna que se utiliza para prevenir la COVID-19 causada por el SARS-CoV-2. Se administra a grupos poblacionales con alto riesgo de complicaciones de 18 años y mayores que han recibido previamente al menos la primera vacunación frente a la COVID-19. El principio activo de Spikevax bivalent Original/Omicron BA.4-5 es ARNm que codifica la proteína de la espícula del SARS-CoV-2. El ARNm está encapsulado en nanopartículas lipídicas SM-102.Spikevax bivalent Original/ Omicron BA.4-5 únicamente puede administrarse a personas que ya han recibido previamente al menos la primera vacunación frente a la COVID-19.
Debido a que Spikevax bivalent Original/Omicron BA.4-5 no contiene el virus, no puede causarle la COVID-19.
1.2 Cómo funciona la vacuna
Spikevax bivalent Original/Omicron BA.4-5 estimula las defensas naturales (sistema inmunitario) del organismo. La vacuna funciona haciendo que el organismo genere protección (anticuerpos) contra el virus que causa la COVID-19. Spikevax bivalent Original/Omicron BA.4-5 utiliza una sustancia llamada ácido ribonucleico mensajero (ARNm) para transportar instrucciones con las que las células del organismo pueden producir la proteína de las espículas que también está en el virus. A continuación, las células fabrican anticuerpos frente a proteína de las espículas para ayudar a luchar contra el virus. Esto ayudará a protegerle frente a la COVID-19.
2 Presentación
Caja con 10 viales multidosis. Vial por 5 dosis de 0,5 ml cada una.
Cada vial contiene 2,5 ml de suspensión en una vial multidosis (vidrio de tipo 1 o de equivalente de vidrio de tipo 1 o de polímero de olefina cíclica con revestimiento interior de barrera) con un tapón (caucho de clorobutilo) y precinto con cápsula de cierre extraíble de plástico de color azul (precinto de aluminio).
3 Composición
Cada dosis (0,5 ml) contiene 25 microgramos de elasomerán y 25 microgramos de devasomerán, una vacuna de ARNm frente a la COVID-19 (encapsulado en nanopartículas lipídicas SM-102).
Elasomerán es un ARN mensajero (ARNm) monocatenario con caperuza en el extremo 5' producido mediante transcripción in vitro acelular a partir de los moldes de ADN correspondientes, que codifica la proteína de la espícula (S) viral del SARS-CoV-2 (Original).
Davesomerán es un ARN mensajero (ARNm) monocatenario con caperuza en el extremo 5', fabricado mediante transcripción in vitro sin células a partir de las plantillas de ADN correspondientes, que codifican la proteína de la espícula (S) del SARS-Cov-2 (variante ómicron BA.4-5). Las proteínas S de los linajes BA.4 y BA.5 de la variante ómicron del SARSCoV-2 son idénticas.
4 Forma farmacéutica moderna
Suspensión inyectable vial x 5 dosis de 0.5 ml cada una.
5 Indicaciones
Spikevax bivalent® Original/Ómicron BA.4-5 está indicada para la inmunización activa para prevenir la COVID-19, causada por el virus SARS-CoV-2, en grupos poblaciones con alto riesgo de complicaciones de 18 años de edad y mayores que han recibido previamente al menos la primera vacunación frente a la COVID- 19.
6. Vida útil y condiciones de almacenamiento Spikevax bivalent® Original/Ómicron BA.4-5 Adulto
Vial multidosis sin abrir 9 meses entre -50 oC y -15 oC
Durante el período de 9 meses, una vez sacado del congelador, el vial de la vacuna sin abrir puede almacenarse refrigerada entre 2 oC y 8 oC, protegida de la luz, durante un máximo de 30 días. Dentro de este periodo, se puede transportar durante 12 horas a una temperatura de entre 2 oC y 8 oC.
También se ha demostrado la estabilidad química y física de los viales de la vacuna sin abrir si se almacenan durante 12 meses entre -50 oC y -15 oC, siempre que, una vez descongelados y almacenados a una temperatura de entre 2 oC y 8 oC, protegidos de la luz, el vial sin abrir se utilice en un plazo máximo de 14 días (en lugar de 30 días, cuando se ha almacenado entre -50 oC y -15 oC durante 9 meses), pero sin exceder el período de almacenamiento máximo de 12 meses. Una vez descongelada, la vacuna no se debe volver a congelar.
La vacuna sin abrir puede almacenarse entre 8 oC y 25 oC durante 24 horas tras retirarla de las condiciones de refrigeración.
Vial multidosis perforado
La estabilidad química y física en uso ha sido demostrada durante 19 horas entre 2 oC y 25 oC después de la primera perforación (dentro del periodo de uso permitido de 30 días o 14 días, respectivamente, entre 2 oC y 8 oC, que incluye 24 horas entre 8 oC y 25 oC). Desde un punto de vista microbiológico, el medicamento debe utilizarse de inmediato. Si la vacuna no se utiliza inmediatamente, los tiempos y las condiciones de conservación durante el uso son responsabilidad del usuario.
7 Inmunogenicidad y seguridad
Información sobre la seguridad e inmunogenicidad del bivalente que contiene ómicron BA.4/BA.5.
Métodos
En este ensayo en curso de fase 2/3, 50 íg de ARNm- Bivalente (25 íg de cada Wuhan- Hu-1 ancestral y ARNm de pico omicron BA.4/BA.5) se compara con 50 íg de ARNm-administrado como segundos refuerzos en adultos que previamente recibieron una serie primaria de 2 inyecciones (100 íg) y un primer refuerzo (50 íg) de dosis de ARNm-. Los objetivos principales fueron la seguridad y la inmunogenicidad 28 días postaplicación.
Resultados
Los participantes recibieron 50 íg de ARNm- (n=376) o ARNm- Bivalente (n=511) como segunda dosis de refuerzo. Se evaluaron anticuerpos neutralizantes de Ómicron BA.4/BA.5 y ancestral SARS-CoV-2.
Los Títulos Medios Geométricos obtenidos después de la vacunación (GMT [intervalo de confianza del 95%]) después de mRNA- Bivalente (2324.6 y 7322.4) fueron significativamente más altos que el ARNm- (488.5 y 5651,4) respectivamente, el día 29 después del refuerzo en participantes con sin infección previa por SARS-CoV-2. Un subgrupo seleccionado aleatoriamente (N=60) de participantes en el grupo mRNA-Bivalente también exhibió neutralización cruzada contra el ómicron emergente.
variantes BQ.1.1 y XBB.1. No se identificaron nuevos problemas de seguridad con el ARNm- Bivalente.
Conclusión
La vacuna bivalente ómicron BA.4/BA.5 que contiene ARNm- Bivalente obtuvo resultados superiores en respuesta de anticuerpos neutralizantes contra BA.4/BA.5 en comparación con mRNA ancestral, sin preocupaciones de seguridad identificadas. (Con el respaldo de Moderna; Identificador de ClinicalTrials.gov: NCT04927065).
Dosis, vía y sitio de administración para personas mayores de 18 años
| Dosis | Vía de aplicación | Sitio de aplicación |
| 0,5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. |
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
8 Coadministración con otras vacunas
- Vacuna Moderna bivalente se puede administrar con otras vacunas incluyendo influenza y neumococo.
9 Preparación de la vacuna
9.1 Procedimiento para la descongelación de la vacuna
- El vial multidosis se almacena congelado y debe descongelarse antes de su uso.
- Una vez abierta, descongelar los viales introduciéndolos al refrigerador para descongelarlos a una temperatura de +2 oC a +8 oC, alrededor de 2 horas y 30 minutos o dejar el vial 1 hora a temperatura ambiente (entre 15 oC y 25 oC).
- Antes de administrar la vacuna dejar el vial a temperatura ambiente durante 15 minutos y marcar el vial con la fecha y hora de descongelación (Nota: NO descongelar los viales desde el día anterior).
9.2 Procedimiento para la administración de la vacuna
- La vacuna debe ser administrada por personal de la salud mediante técnicas asépticas para garantizar la esterilidad del procedimiento.
- Inicialmente realice lavado o higiene de manos.
- La vacuna está lista para usarse una vez descongelada.
- Verifique que el líquido tiene un color blanco o blanquecino tanto en el vial como en la jeringa.
- La vacuna puede contener partículas blancas o transparentes relacionadas con el producto.
- Gire el vial suavemente después de la descongelación y antes de cada extracción. No agitar ni sacudir.
- Una vez descongelado el vial de la vacuna se pueden cinco (5) dosis (de 0,5 ml cada una).
- Una vez descongelado el vial de la vacuna NO volver a congelar.
- Extraiga la dosis de 0,5 ml de vacuna con una aguja y una jeringa estériles de 1 ml (22G o 23G) convencional o auto descartable según disponibilidad y deseche cualquier vacuna no utilizada dentro de las 19 horas posteriores a la extracción de la primera dosis.
- Si la dosis es incorrecta, o hay un cambio de color y otras partículas presentes, no se debe administrar la vacuna.
Nota: verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante, si es así siga el si guiente flujo de información:
- Reporte al coordinador del punto de vacunación su hallazgo.
- No utilice el vial, sepárelo y márquelo como cuarentena.
- Realice un video del vial, evidenciando su hallazgo.
- Realice el reporte al coordinador municipal por correo electrónico, indicando lote y fabricante y envíe la evidencia.
- Reporte al nivel municipal, departamental o distrital.
- El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin.
- Este Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
- Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
- Al finalizar la jornada diaria se deben identificar las dosis sobrantes por inasistencia de personas a las citas o disminución del cálculo de la pérdida por frasco abierto.
- Posteriormente, identificar la población que no se encuentre vacunada y aplicar la vacuna priorizando según fase y etapa en la cual se está desarrollando la vacunación. Si es el caso, usar la(s) dosis en personas incluidas en la siguiente etapa.
- Es importante mencionar que todas las personas a, deben seguir todo el proceso de vacunación, que incluye entre otros, diligenciar y firmar el consentimiento informado, recibir la información relacionada con la vacuna, permanecer el tiempo asignado en las instalaciones posterior a la vacunación según su condición, registrar la información en el PAIWEB y recibir el carné de vacunas.
9.3 Técnica para aplicar la vacuna
- Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
- Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
- Con una mano estire la piel con los dedos pulgar e índice.
- Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90o sobre el plano de la piel.
- Introduzca la aguja por vía intramuscular.
- Presione el émbolo para que penetre la vacuna.
- Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
- Estire la piel para perder la luz del orificio que dejó la aguja.
- Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
10 Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de que le administren Spikevax bivalent Original/Omicron BA.4-5 si:
- Ha tenido previamente una reacción alérgica grave, potencialmente mortal después de cualquier otra vacuna o después de haber recibido Spikevax (Original) en el pasado.
- Tiene un sistema inmunitario muy débil o deteriorado.
- Se ha desmayado alguna vez tras cualquier inyección de aguja.
- Tiene algún trastorno hemorrágico.
- Tiene fiebre alta o una infección grave; no obstante, puede ser vacunado si tiene fiebre leve o una infección de las vías respiratorias altas como un resfriado.
- Tiene alguna enfermedad grave.
- Tiene ansiedad relacionada con las inyecciones.
Hay un mayor riesgo de miocarditis (inflamación del músculo cardiaco) y pericarditis (inflamación del revestimiento externo del corazón) después de la vacunación con Spikevax (Original).
Estos trastornos pueden aparecer a los pocos días de la vacunación y se han producido principalmente en un plazo de 14 días. Se han observado con mayor frecuencia tras la segunda dosis de la vacunación que tras la primera, con mayor frecuencia en varones jóvenes.
Después de la vacunación, debe estar alerta a los signos de miocarditis y pericarditis, como dificultad para respirar, palpitaciones y dolor torácico, y debe buscar atención médica inmediata en caso de que aparezcan. Si se encuentra en alguna de las circunstancias anteriores, (o no está seguro), consulte a su médico, farmacéutico o enfermero antes de que le pongan Spikevax bivalent Original/ Omicron BA.4-5.
10.1. Exacerbaciones del síndrome de extravasación capilar
Se han notificado algunos casos de exacerbación del síndrome de extravasación capilar (que provoca la salida de líquido de los vasos sanguíneos pequeños o capilares, lo que produce una hinchazón rápida de los brazos y las piernas, aumento repentino de peso y sensación de desmayo y tensión arterial baja) tras la vacunación con Spikevax (Original). Si ha tenido episodios anteriores de síndrome de extravasación capilar, consulte a su médico antes de recibir Spikevax bivalent Original/Omicron BA.4-5.
Duración de la protección como con cualquier vacuna, la tercera dosis de Spikevax bivalent Original/Omicron BA.4-5 puede no proteger completamente a todas las personas que la reciban y no se sabe cuánto tiempo estará usted protegido.
No se recomienda utilizar Spikevax bivalent Original/Omicron BA.4-5 en niños menores de 18 años.
10.2 Otros medicamentos y Spikevax bivalent Original/Omicron BA.4-5
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento. Spikevax bivalent Original/ Omicron BA.4-5 puede afectar a la forma en que funcionan otros medicamentos, y otros medicamentos pueden afectar a la forma en que funciona Spikevax bivalent Original/ Omicron BA.4-5.
10.3 Personas inmunocomprometidas
Es posible que la eficacia de Spikevax bivalent Original / Omicron BA.4-5 sea menor en personas inmunocomprometidas. En estos casos, debe seguir manteniendo las precauciones físicas para evitar la 3 COVID-19. Por otra parte, las personas más cercanas a usted deben ser vacunadas según proceda. Consulte con su médico las recomendaciones individuales adecuadas.
10.4 Embarazo y lactancia
Si está embarazada o cree que podría estar embarazada, informe a su médico, enfermero. No se dispone aún de datos sobre el uso de Spikevax bivalent Original/Omicron BA.4-5 durante el embarazo.
No se dispone aún de datos sobre el uso de Spikevax bivalent Original/Omicron BA.4-5 durante la lactancia.
10.5 Conducción y uso de máquinas
No conduzca ni use máquinas si se encuentra mal tras la vacunación. Espere a que estos efectos hayan desaparecido antes de conducir o utilizar máquinas.
Spikevax bivalent Original/Omicron BA.4-5 contiene sodio
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis; esto es, esencialmente “exento de sodio”.
1.1 Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran.
Busque atención médica urgente si tiene alguno de los siguientes signos y síntomas de reacción alérgica:
- sensación de mareo o aturdimiento;
- cambios en los latidos del corazón;
- falta de aliento;
- sibilancias;
- hinchazón de los labios, la cara o la garganta;
- ronchas o erupción en la piel;
- náuseas o vómitos;
- dolor de estómago.
Consulte a su médico o enfermero si experimenta cualquier otro efecto adverso. Estos pueden incluir:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- Hinchazón/dolor a la palpación en la axila.
- Disminución del apetito (observada en niños de 6 meses a 5 años).
- Irritabilidad o llanto (observado en niños de 6 meses a 5 años).
- Dolor de cabeza somnolencia (observada en niños de 6 meses a 5 años).
- Náuseas.
- Vómitos.
- Dolor y rigidez muscular y de las articulaciones.
- Dolor o hinchazón en el lugar de la inyección.
- Enrojecimiento en el lugar de la inyección (en ocasiones se produce aproximadamente entre 9 y 11 días después de la inyección).
- Sentirse muy cansado - escalofríos.
- fiebre.
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- diarrea.
- erupción cutánea.
- erupción cutánea o urticaria en el lugar de la inyección (algunos de los cuales pueden producirse aproximadamente de 9 a 11 días después de la inyección).
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- Picor en el lugar de inyección.
- Mareos.
- Dolor de estómago.
- Erupción cutánea elevada y pruriginosa (urticaria) (que puede aparecer desde el momento de la inyección hasta aproximadamente dos semanas después de la inyección).
Raros (pueden afectar hasta 1 de cada 1000 personas):
- Caída facial unilateral temporal (parálisis de Bell).
- Hinchazón de la cara (la hinchazón de la cara puede ocurrir en pacientes que han recibido inyecciones estéticas faciales).
- Disminución del sentido del tacto o dolor a la palpación de la piel.
- Sensación inusual en la piel, como sensación de hormigueo (parestesia).
Muy raros (pueden afectar hasta 1 de cada 10 000 personas):
- Inflamación del músculo cardiaco (miocarditis) o inflamación del revestimiento externo del corazón (pericarditis) que puede dar lugar a dificultad para respirar, palpitaciones o dolor torácico.
Frecuencia no conocida
- Reacciones alérgicas graves con dificultad para respirar (anafilaxia)
- Reacción de aumento del dolor a la palpación o intolerancia del sistema inmunitario (hipersensibilidad a la palpación)
- Una reacción cutánea que causa puntos rojos o manchas en la piel, que pueden parecer una diana u (ojo de buey) con un centro de color rojo oscuro rodeado de anillos rojos más pálidos (eritema multiforme).
- Inflamación extensa de la extremidad vacunada.
- Hemorragia menstrual abundante (la mayoría de los casos no parecen ser graves y son de carácter temporal).
11.1. Comunicación de efectos adversos
Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de esta vacuna.
12 Vacunación segura
Antes de recibir la vacuna Moderna ARNm- debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si:
- Tiene alguna alergia. Es importante indagar al usuario si ha presentado reacción alérgica grave.
- Si alguna vez se ha desmayado después de una inyección con aguja.
- Tiene fiebre
- Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre).
- Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer).
- Ha recibido otra vacuna contra la COVID-19.
- En caso de ser mujer en edad reproductiva preguntar:
- Está embarazada o planea quedar embarazada.
- Está amamantando.
Referencias
1. Wang F, Kream RM, Stefano GB. An evidence based perspective on mRNA-SARS-CoV-2 Vaccine Development. Med Sci Monit. 2020;26:1-8.
2. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-SARS-CoV-2 Vaccine. N Engl J Med. 2020;403-16.
3. World Health Organization. Interim recommendations for use of the Moderna ARNm-vaccine against COVID-19. 2021;(January):1-8. Available from: https://apps. who.int/iris/bitstream/handle/10665/338862/WHO-2019-nCoV-vaccines-SAGE_ recommendation-mRNA--2021.1-eng.pdf?sequence=1&isAllowed=y.
4. World Health Organization. Interim recommendations for use of the Moderna ARNm- vaccine against COVID-19. Update 15 June. World Heal Organ [Internet]. 2021;1-11. Available from: WHO/2019-nCoV/vaccines/SAGE_recommendation/ BNT162b2/2021.1 Resolución número 2023001963 de 19 de enero de 2023, Por la cual se Modifica una ASUE.
5. Invima. Resolución número 2021025857 de 25 de junio de 2021. Autorización Sanitaria de Uso de Emergencia (ASUE) para la COVID-19 Vaccine Moderna Switzerland GMBH. 2021;1-20.
6. Centers for Disease Control Prevention. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States (Internet). 2021 (cited 2021 Jan 18). Available from: https://www.cdc.gov/ vaccines/COVID-19/info-by-product/clinical-considerations.html?CDC_AA_ refVal=https%3A%2F%2Fwww.cdc.gov%2Fvaccines%2FCOVID-19%2Finfo-by-product%2Fpfizer%2Fclinical-considerations.html#Administration.
7. Dirección General de Salud Pública (Consejería de Sanidad). Anexo 2o. Vacuna COVID-19 ARNm, Moderna. Comunidad de Madrid. 2021;1-9.
8. European Medicines Agency (EMA). Ficha técnica o resumen de las características del producto COVID-19 Vaccine Moderna. 2021;1-27.
9. Food and Drug Administration. Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (EUA) of The moderna COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19). 2020;1-22. Available from: https://search.bvsalud.org/global-literature-on-novel-coronavirus- 2019-ncov/resource/en/grc-740221.
10. Instituto Nacional de Salud - Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. (Internet). 2021. Available from: https://www.ins.gov.co/ buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf.
11. Invima. Resolución número 2022019162 de 24 de junio de 2022. Autorización Sanitaria de Uso de Emergencia (ASUE) para la COVID-19 Vaccine Moderna Switzerland GMBH. 2021;1-20.
12 N Engl J Med 2022; 387:1673-87. DOI: 10.1056/NEJMoa2209367, nejm.org November 3, 2022.
13 Spyros C. medRxiv 2022.12.11.22283166.
14 Ferdinands JM. Waning 2-Dose and 3-Dose Effectiveness of mRNA Vaccines Against COVID-19-Associated Emergency Department and Urgent Care Encounters and Hospitalizations Among Adults During Periods of Delta and Omicron Variant Predominance - VISION Network, 10 States, August 2021-January 2022. MMWR Morb Mortal Wkly Rep. 2022 Feb 18;71(7):255-263.
15 Lin DY, N Engl J Med. 2023 Feb 23;388(8):764-766.
16 Resolución número 2023001963 de 19 de enero de 2023.
17 Inserto vacuna Moderna pediátrica SpikevaxCOVID-19 Vaccine Moderna.
18 Resolución número 2023029356 de 30 de junio de 2023.
19. Inserto vacuna Moderna bivalente Spikevax Bivalent Original/Omicron BA.4-5.
20. https://www.nejm.org/doi/pdf/10.1056/NEJMoa2209367?articleTools=true.
21. NCT04927065.









