 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
RESOLUCIÓN 1656 DE 2021
(octubre 22)
Diario Oficial No. 51.835 de 22 de octubre de 2021
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
<NOTA DE VIGENCIA: Resolución derogada por el artículo 3 de la Resolución 1866 de 2021>
Por la cual se modifican los Anexos Técnicos 1, 6, 8 y 10 de la Resolución 1151 de 2021 en relación con la vacunación inadvertida a gestantes, aplicación de dosis de refuerzo, reducción de plazo para vacunación de personas con antecedentes de Covid-19 e inclusión de población mayor de 12 años con el biológico Moderna RNAm-1273
EL MINISTRO DE SALUD Y PROTECCIÓN SOCIAL,
en ejercicio de sus facultades, especialmente de las conferidas por el literal b) del artículo 488 de la Ley 9 de 1979, los numerales 3 del artículo 173 de la Ley 100 de 1993, 42.1 del artículo 42 de la Ley 715 de 2001, 3, 4 y 9 del artículo 2o del Decreto Ley 4107 de 2011, 19.1 del artículo 19 y parágrafo 9 del artículo 7o del Decreto 109 de 2021, en desarrollo del inciso segundo del artículo 592 de la Ley 9 de 1979 y,
CONSIDERANDO:
Que, con ocasión a la pandemia actual por la que atraviesa el mundo ocasionada por la Covid-19, el Gobierno nacional, entre otras medidas, adoptó el Plan Nacional de Vacunación definido por el Decreto 109 de 2021, modificado por los Decretos 404, 466, 630 y 744 de 2021, y en desarrollo de este, se han proferido las Resoluciones 197, 430, 1151 de 2021, esta última modificada por las Resoluciones 1379 y 1426 de 2021, mediante las cuales este Ministerio adoptó y ha venido actualizando los lineamientos técnicos y operativos para la vacunación contra el Covid-19, conforme a la evolución de la pandemia y la evidencia científica sobre la vacuna.
Que el Instituto de Vigilancia de Medicamentos y Alimentos (Invima) a través de la Resolución 2021005436 del 23 de febrero de 2021 concedió la Autorización de Uso de Emergencia ASUE 2021-000002, para la Vacuna contra Covid-19 (ChAdOx1-S* recombinante o AZD1222) del laboratorio AstraZeneca, en la que, entre otros aspectos, dispuso que la segunda dosis debe administrarse entre 4 y 12 semanas después de la primera.
Que mediante Resolución 2021038171 del 3 de septiembre de 2021, el Invima modificó la citada Resolución 2021005436 del 23 de febrero de 2021, en el sentido de incluir una nueva presentación de la vacuna del grupo CHADOX1-S/NCOV-19 (ASTRAZENECA) contra el COVID-19.
Que el Ministerio de Salud y Protección Social realizó, durante el periodo entre el 11 de marzo y el 11 de agosto de 2021, el estudio “Efectividad de las vacunas contra el Covid-19 en Colombia Estudio de cohorte de base poblacional en adultos de 60 años y más” en el que evidenció que a pesar de que la efectividad de la vacunación decae con la edad, la aplicación de una dosis adicional incrementa la respuesta inmune lo cual puede aumentar la protección contra la infección por Sars-CoV-2
Que la Dirección de Medicamentos y Tecnologías de Salud de este Ministerio, mediante memorando 202124000287343 señaló que con fundamento en el documento “REVISIÓN SISTEMÁTICA RÁPIDA. ESQUEMAS DE VACUNACIÓN HETERÓLOGOS” es pertinente la administración del esquema de vacunación heterólogo.
Que con base en lo anterior, el Comité Asesor del Ministerio de Salud y Protección Social para el proceso estratégico de inmunización de la población colombiana frente a la Covid-19 en sesión del 16 de septiembre de 2021, analizó los beneficios de aplicar una tercera dosis en población mayor de 70 años, teniendo en cuenta adicionalmente, las recomendaciones propuestas en las reuniones sostenidas el 10 y 11 de agosto de 2021, por el grupo de vacunas del Consenso Colombiano de Atención, Diagnóstico y Manejo de la Infección por SARS-CoV-2/COVID-19 en Establecimientos de Atención de la Salud y por la Asociación Colombiana de Infectología ACIN, mediante comunicación radicada con el número 202142301622212, recomendando que este refuerzo puede ser aplicado con una dosis de biológicos homólogos o con plataformas ARNm, independiente de la plataforma que previamente haya recibido.
Que el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), profirió la Resolución 2021041443 de 21 de septiembre de 2021, mediante la cual modificó la Resolución 2021025857 de 25 de junio de 2021, mediante la cual se concedió la Autorización de Uso de Emergencia (ASUE) y aprobó la utilización de Covid-19 Vaccine Moderna para prevenir la enfermedad por coronavirus de 2019 (Covid-19), en personas adultas y niños de 12 años o más; así como la modificación de precauciones y advertencias, modificación de reacciones adversas, el inserto e información para prescribir.
Que el Comité Asesor del Ministerio de Salud y Protección Social para el proceso estratégico de inmunización de la población colombiana frente a la Covid-19, en sesión del 05 de octubre de 2021, analizó la situación de la vacunación que se ha presentado en mujeres que desconociendo estar embarazadas recibieron como primera dosis, vacunas de AstraZeneca, Moderna o Sinovac y con base en la recomendación de la Federación Colombiana de Obstetricia y Ginecología – Fecolsog, allegada mediante radicado No. 202142301965052 dispuso la aplicación de la vacuna del biológico Pfizer, único autorizado a la fecha para mujeres con más de 12 semanas de gestación.
Que algunos países requieren como requisito de ingreso una dosis adicional de refuerzo para permitir el ingreso de extranjeros a su territorio, razón por la cual se autorizará la aplicación con el biológico disponible a personas que se desplacen en representación del Estado o en el ejercicio de sus funciones.
Que el Comité Asesor del Ministerio de Salud y Protección Social para el proceso estratégico de inmunización de la población colombiana frente a la Covid-19, en sesión del 21 de octubre de 2021, recomendó realizar la vacunación de personas recuperadas de Covid-19, a partir del día 30 después de la infección, teniendo en cuenta que no existe contraindicación para vacunarlas más tempranamente.
Que, por consiguiente, se hace necesario modificar los lineamientos técnicos y operativos de la vacunación contra el Covid-19 adoptados mediante el Anexo 1 de la Resolución 1151 de 2021, sustituir los Anexos Técnicos 6, 8 y 10 y derogar la Resolución 1426 de 2021.
Que, en mérito de lo expuesto,
RESUELVE
ARTÍCULO 1o. <Resolución derogada por el artículo 3 de la Resolución 1866 de 2021> Modificar el Anexo Técnico 1 “Lineamientos técnicos y operativos para la vacunación contra el Covid-19” de la Resolución 1151 de 2021, en los siguientes términos:
1.1. Modificar el numeral 3 “POBLACIÓN OBJETO” el cual quedará así:
“3. POBLACIÓN OBJETO
De acuerdo con las recomendaciones de la OMS, para reducir la morbilidad, mortalidad y proteger los sistemas de salud, se debe realizar la vacunación de manera escalonada iniciando con la población priorizada. Esto debido a que la producción inicial de la vacuna contra la Covid-19 es limitada, siendo un reto maximizar su uso para tener mayor impacto en la salud.
Por lo anterior, el Ministerio de Salud y Protección Social lideró un proceso interdisciplinario, interinstitucional e intersectorial con base en la evidencia científica disponible y con el acompañamiento del Comité Asesor de Vacunas Covid-19, la Instancia Asesora Intersectorial y el Comité Nacional de Prácticas en Inmunizaciones (CNPI) avanzó en la definición de la población priorizada a vacunar en cada una de las etapas definidas en las dos fases del Plan Nacional de Vacunación contra el Covid-19.
El proceso de priorización de la población se encuentra descrito en el Plan Nacional de Vacunación contra el Covid-19, en donde se planteó como propósito la inmunidad del 70% de la población, es decir, a 35.734.649 de los 51.049.498 habitantes proyectados para Colombia durante el año 2021 para avanzar en el objetivo de la inmunidad de rebaño o inmunidad colectiva.
Para la vacunación de la población menor de 18 años se aplicará el biológico que de acuerdo con las recomendaciones del laboratorio fabricante así lo establezca o cuando la evidencia científica lo permita”.
1.2. Modificar los numerales 5.1 “Disposición de la información de la población a vacunar”, 5.3.2 “Vacunación en personas con antecedentes de Covid-19 confirmado” y 5.4. “Aplicación y registro de la vacuna” del numeral 5. “RUTA DE VACUNACIÓN”, los cuales quedarán así:
“5. RUTA DE VACUNACIÓN
5.1. Disposición de la información de la población a vacunar
Los responsables del reporte de información para la identificación nominal deben continuar con la búsqueda y reporte de la población a su cargo, sin que, de manera previa, deba realizarse el registro en la plataforma MIVACUNA COVID19, sin perjuicio de lo cual todas las personas deberán quedar registradas en el sistema de información nominal PAIWEB.
La consulta individual a la plataforma MIVACUNA COVID-19 se realizará en el enlace https://mivacuna.sispro.gov.co/MiVacuna?v1
Figura 1
(…)
5.3.2 Vacunación en personas con antecedentes de COVID-19 confirmado
Las personas con antecedente de Covid-19 o personas con inmunosupresión de cualquier origen, ya sea por enfermedad o como tratamiento de alguna condición con antecedente de Covid-19 confirmado serán vacunadas como mínimo treinta (30) días después de la fecha de inicio de síntomas en personas sintomáticas o treinta (30) días contados desde la fecha de la toma de la muestra para personas asintomáticas.
5.4 Aplicación y registro de la vacuna
El prestador de servicios de salud debe contar en sus equipos vacunadores con perfiles como un auxiliar o técnico en enfermería o salud pública con experiencia para ser vacunador, auxiliar o técnico o tecnólogo en áreas administrativas que podrá hacer las veces de anotador, técnico en sistemas o auxiliar en salud pública o en enfermería o áreas administrativas que podrá hacer las veces de digitador y un profesional en medicina o enfermería, quién hará las veces de supervisor. Para actividades extramurales el prestador debe disponer de un supervisor quien tendrá a cargo los equipos dispuestos y contar con talento humano en salud entrenado para identificar posibles reacciones alérgicas de tipo inmediato incluida la anafilaxia, cuando las condiciones técnicas de la vacuna así lo requieran.
Así mismo deberá cumplir con las medidas de bioseguridad en todo el proceso de la vacunación, manejo de la cadena de frío, manejo de residuos generados y el procedimiento para garantizar la vacunación segura y contar con talento humano en salud entrenado para identificar posibles reacciones alérgicas de tipo inmediato incluida la anafilaxia, cuando las condiciones técnicas de la vacuna así lo requieran.
La persona debe presentarse el día y la hora asignada por el prestador de servicios de salud. Los menores de edad deben presentarse con quien ejerza su patria potestad o quien tenga su custodia quienes también deben suscribir el documento en donde consta el consentimiento informado del menor. Quienes hayan sido declarados incapaces por sentencia judicial comparecerán en los términos de la Ley 1996 de 2019 y aquellos que no sepan o no puedan firmar, podrán firmar a ruego.
Durante el tiempo que permanezca la persona en observación posterior a la vacunación, el prestador de servicios de salud deberá desarrollar actividades de comunicación e información en salud, en el marco de la ruta de atención de acuerdo con el curso de vida en que se encuentre el usuario y en caso de presentarse una reacción adversa grave al momento de la vacunación, iniciará el protocolo de atención y activará el sistema de referencia y contrarreferencia en el caso de requerirlo.
Las personas que asistan para aplicar la segunda dosis de la vacuna a un lugar diferente a aquel en el que recibieron su primera dosis, incluso si esta fue aplicada en otro país, podrán ser vacunadas y registradas, respetando la etapa de priorización en la que se encuentren, si el prestador cuenta con una vacuna del mismo laboratorio.
Si la persona agendada no asiste a la cita asignada o por algún motivo no fue vacunada, el prestador de servicios de salud debe reagendar la cita, de acuerdo con la disponibilidad de la vacuna contra la Covid-19”.
1.3. Modificar los numerales 8.3 “Consideraciones antes de administrar la vacuna en pacientes con cáncer o inmunosupresión” y 8.5 “Consideraciones respecto a la vacunación de gestantes” y adicionar los numerales 8.7 “Consideraciones relacionadas con la aplicación de refuerzos en población priorizada” y 8.8 “Aplicación de dosis adicional por solicitud de país extranjero” en el numeral 8. “VACUNACIÓN SEGURA”, en los siguientes términos:
“8.3 Consideraciones antes de administrar la vacuna en pacientes con cáncer o inmunosupresión:
a) Para los pacientes con neoplasias en tratamiento activo se recomienda aplicar la vacuna entre ciclos de terapia y después de períodos de espera, idealmente se debería programar la fecha de vacunación según el concepto del médico tratante. La imposibilidad de obtener dicho concepto no debe contraindicar la vacunación en ninguna circunstancia.
b) En pacientes inmunosuprimidos la protección que provee la vacuna contra SARS-CoV-2, al igual que otras vacunas puede estar comprometida. Por lo tanto, frente a los que han recibido tratamientos que producen depleción de células B (uso de globulina antitimocito, rituximab, obinutuzumab) se debe posponer de 3 a 6 meses la vacunación, en analogía con otras vacunas.
(…)
8.5 Consideraciones respecto a la vacunación de gestantes
Mediante la Resolución 2021027977 del 9 de Julio de 2021 el Invima resolvió actualizar la Resolución 2021000183 del 5 de enero del 2021, mediante la cual se concedió la Autorización de Uso de Emergencia No ASUE 2021-000001 para la vacuna Pfizer-BioNTech COVID-19 Vaccine a favor de PFIZER Inc., por el término de un año, incluyendo en las precauciones y advertencias que se puede considerar su administración en mujeres gestantes desde la semana doce (12) y las mujeres durante los 40 días posparto, “si los posibles beneficios superan los posibles riesgos con base en la evaluación clínica realizada en conjunto por el médico tratante y la gestante” (Énfasis fuera del texto)
Ahora bien, el único requisito que se debe exigir para la aplicación de la vacuna de Pfizer-BioNTech en mujeres embarazadas, es la suscripción del consentimiento informado en donde manifieste que realizó previamente la evaluación riesgo – beneficio junto con su médico tratante.
A la fecha, el uso en mujeres gestantes, de los demás biológicos que tienen Autorización Sanitaria de Uso de Emergencia, no reporta evidencia suficiente para establecer el balance riesgo – beneficio, por lo tanto, solo se podrá aplicar la vacuna de Pfizer-BioNTech Covid-19 a esta población.
Adicionalmente, el Ministerio de Salud y Protección Social, con el acompañamiento de la Federación Colombiana de Obstetricia y Ginecología FECOLSOG, evaluó en detalle los elementos y recomendaciones frente al riesgo beneficio de la vacunación en gestantes para prevenir la infección por SARS-CoV-2/COVID-19 y analizó la situación de la vacunación que se ha presentado en mujeres que desconocían su condición clínica de estado de embarazo al recibir un biológico que no tiene autorización actual para esta población y se consensuó priorizar y aplicar el biológico autorizado del Laboratorio farmacéutico de Pfizer-BioNTech a las gestantes para la vacunación, en los siguientes términos:
- Dado que el embarazo se considera factor independiente de riesgo para enfermedad grave o muerte por COVID-19, la adolescencia no debe ser una limitante para acceder a la vacunación de gestantes, siempre y cuando las indicaciones del biológico lo permitan.
- No debe restringirse el acceso a la vacunación en las pacientes con fetos malformados o aquellas que soliciten acceder a interrupción voluntaria del embarazo.
- La segunda dosis del biológico deberá administrase en el tiempo establecido, incluso si ha pasado el día 40 posparto.
- La segunda dosis deberá aplicarse con el mismo biológico y en los tiempos recomendados, esto es 21 días desde la primera dosis.
- En el caso de anafilaxia, no se deberá recibir una segunda dosis del biológico
Ante la presencia de las categorías de efectos vaso-vagales o secundarios locales y sistémicos, se administrará la segunda dosis de este biológico.
- Las mujeres gestantes desde la semana doce (12) y las que se encuentren dentro de los 40 días postparto, pueden acceder a la vacunación con el biológico de PFIZER-BioNTech, independientemente de su condición migratoria. La aplicación se reportará en PAIWEB, sin que se requiera un registro previo de identificación.
- Aplicar la segunda dosis en mujeres gestantes a partir de las 12 semanas y hasta los 40 días postparto que tuvieron una primera dosis inadvertida de un biológico que no estaba autorizado para este grupo, esto es, AstraZeneca, Moderna o Sinovac, completando el esquema con el biológico autorizado.
Durante la gestación de acuerdo con la norma técnica deben administrarse adicionalmente:
- Influenza estacional: Una dosis a partir de la semana 14 de gestación.
- TdaP (Tétanos - Difteria - Tos ferina Acelular): Dosis única a partir de la semana 26 de gestación.
El Centro para el Control y la Prevención de Enfermedades (CDC) de Atlanta, en su publicación “Consideraciones clínicas provisionales para el uso de vacunas Covid-19 actualmente autorizadas en los Estados Unidos”, en relación con la coadministración con otros biológicos, refiere que la vacuna contra el Covid – 19 y otras vacunas se pueden administrar el mismo día, así como con cualquier intervalo, sin necesidad de guardar un tiempo mínimo entre una vacuna y otra. Lo anterior aplica, como lo indica el texto citado, solo para las vacunas contra el Covid – 19 autorizadas por la FDA en los E.E.U.U (Pfizer- BioNTech, Moderna y Janssen).
Para las demás vacunas contra el Covid – 19 de los laboratorios Sinovac y AstraZeneca, disponibles en Colombia, no existe aún suficiente evidencia científica que permita la coadministración con otros biológicos, por lo tanto, las personas que reciban vacuna contra Covid – 19 de uno de los laboratorios mencionados, deberá conservar un periodo mínimo 14 días antes o después de la administración de cualquier otra vacuna. En la medida en que avancen los estudios relacionados con estas vacunas, se actualizarán las indicaciones técnicas relacionadas con la aplicación simultánea con otras vacunas.
Si se va a administrar la vacuna contra el COVID-19 de los laboratorios Pfizer- BioNTech, Moderna y Janssen y la vacuna contra influenza en una sola visita, el sitio anatómico de aplicación debe ser diferente, la vacuna contra el COVID-19 se aplica en el brazo izquierdo y la vacuna contra influenza estacional en el brazo derecho. En caso de requerirse aplicar la vacuna en el mismo brazo, para adolescentes y adultos, el músculo deltoides puede usarse para más de una inyección intramuscular, procurando guardar una distancia de mínimo 2 centímetros entre inyección.
En el caso de la aplicación de la inmunoglobulina anti-D para prevención de enfermedad Rh, no debe verse alterada por la vacunación y podría ser administrada incluso en el mismo momento si llegara a ser necesario pues este no afecta la respuesta inmune que genera la vacuna.
(…)
8.7. Aplicación de refuerzos en población priorizada
Las poblaciones que se enuncian en el presente numeral podrán acceder, a una dosis de refuerzo con un biológico homólogo (cuando el esquema inicial usado fue virus inactivado, vector viral o ARNm), o con un biológico heterólogo con plataforma ARNm (cuando el esquema inicial fue vector de vector viral o virus inactivado, de acuerdo con la siguiente tabla.
| Primera dosis | Segunda dosis | Tercera dosis | Plataforma |
| ARNm (Pfizer – Moderna) | ARNm (Pfizer – Moderna) | ARNm (Pfizer – Moderna) | Homóloga |
| Vector Viral (AstraZeneca – Janssen) | Vector Viral (AstraZeneca – Janssen) | ARNm (Pfizer – Moderna) | Heteróloga |
| Vector Viral (AstraZeneca – Janssen) | Homóloga | ||
| Virus Inactivado (Sinovac) | Virus Inactivado (Sinovac) | ARNm (Pfizer – Moderna) | Heteróloga |
| Virus Inactivado (Sinovac) | Homóloga | ||
Población de 12 años en adelante con la siguiente condición clínica:
– Trasplante de corazón
– Trasplante de riñón
– Trasplante de páncreas
– Trasplante de pulmón
– Trasplante de intestino
– Trasplante de hígado
– Trasplante de médula ósea en los 2 años anteriores o que reciben tratamiento de inmunosupresión
– Leucemia en quimioterapia
– Mieloma en quimioterapia
– Linfoma en quimioterapia
– Síndrome mielodisplásico en quimioterapia
– Pacientes con enfermedades autoinmunes como artritis reumatoide, lupus eritematoso sistémico o esclerosis múltiple que reciben tratamiento inmunosupresor y otras enfermedades que usen: alemtuzumab, abatacept, belatacept, obinutuzumab, rituximab, fingolimod, ocrelizumab, antimetabolicos e inhibidores de la calcineurina en último año
– Inmunodeficiencias primarias
b) Población de trasplante de órgano sólido, población de trasplante de progenitores de hematopoyéticos (durante los primeros 2 años o que reciban tratamiento inmunosupresor), pacientes con neoplasia hematológica en quimioterapia activa y pacientes con inmunosupresión severa, como anti-CD 20.
Las poblaciones señaladas en los literales a) y b) podrán recibir el refuerzo después de 30 días de completar el esquema de vacunación.
c) Personas mayores de 70 años a partir de los 6 meses de haber completado el esquema primario.
No se considera necesaria la medición de anticuerpos para determinar la administración de la dosis de refuerzo adicional.”
8.8. Aplicación de dosis adicional por solicitud de país extranjero.
Se podrá aplicar una dosis adicional al esquema del biológico para las personas que requieran cumplir como requisito de ingreso a un país receptor, que se desplacen en representación del Estado o en ejercicio de sus funciones, lo cual se acreditará mediante el acto administrativo que concede la comisión.
1.4. Modificar el numeral 11.1 “Vigilancia de eventos supuestamente atribuidos a vacunación o inmunización” del numeral 11. “VIGILANCIA”, el cual quedará así:
“11. VIGILANCIA
11.1 Vigilancia de eventos supuestamente atribuidos a vacunación o inmunización
La vigilancia de los Eventos Adversos de Especial Interés conocido como AESI por sus siglas en inglés, es una pieza fundamental en la introducción de las nuevas vacunas de COVID-19, con el fin de contribuir a la detección temprana y clasificación adecuada de los ESAVI y señales de riesgo, para generar una respuesta rápida y apropiada a nivel nacional y territorial.
Tiene el propósito de promover la salud pública, proteger a la población de eventuales reacciones adversas y mejorar el acceso. Su alcance va desde la elaboración y distribución, hasta la evaluación de su uso. Cada país, de acuerdo con sus características particulares, debe organizar y establecer el control efectivo de la seguridad y calidad de los medicamentos y en especial de las vacunas, de acuerdo con las pautas internacionales y a las recomendaciones y guías de la OMS.
Es importante mencionar que, para efectos de la vigilancia en salud pública, los prestadores de servicios de salud deberán reportar los ESAVI que pudieran ocurrir durante o posterior a la aplicación de la vacuna. Los eventos que deben ser notificados son aquellos que cumplen con la definición operativa de caso y los siguientes criterios:
a) Eventos que ponen en riesgo la vida.
b) Errores operativos del programa: inyección no estéril, error de reconstitución, lugar anatómico o vía equivocada, almacenamiento incorrecto de vacunas y no respeto a las contraindicaciones.
c) Eventos que requieren hospitalización.
d) Eventos que causan discapacidades.
e) Eventos que estén por encima de la incidencia esperada en un conglomerado de personas.
f) Cualquier muerte que ocurra dentro de las cuatro semanas siguientes a la administración de una vacuna y se relacione con el proceso de vacunación o inmunización.
g) Cualquier rumor sobre la seguridad de una vacuna que se genere en medios de comunicación (ver módulo de capacitación vacunación segura, Washington, EE. UU., 2004).
La vacunación inadvertida en gestantes deja de ser un criterio para identificación como evento supuestamente atribuido a la vacunación para las mujeres a partir de la semana doce (12) de embarazo.
Las mujeres gestantes notificadas vacunadas inadvertidamente hasta la semana once (11) de embarazo se les deberá realizar el seguimiento a cargo de las entidades responsables del aseguramiento en salud”.
1.5. Modificar el numeral 13 “ACCESO, DISTRIBUCIÓN Y LOGÍSTICA DE LA VACUNA” el cual quedará así:
“13. ACCESO, DISTRIBUCIÓN Y LOGÍSTICA DE LA VACUNA
El país tiene una cadena de frío fortalecida para el almacenamiento de los biológicos que hacen parte del esquema nacional de vacunación, garantizando las condiciones de almacenamiento en temperaturas de refrigeración entre +2°C a +8°C.
Este Ministerio utiliza para distribuir las vacunas contra Covid-19, incluidas las que requieren conservación en temperaturas de congelación y ultracongelación, la misma logística que usa dentro del programa regular de vacunaciones es decir, realiza las entregas a las entidades territoriales departamentales y distritales bajo unos estándares preestablecidos y empleando en su mayoría transporte aéreo, con inclusión de transporte terrestre para las ciudades cercanas, estos a su vez distribuyen hacia los centros de acopio municipales.
Las entregas de vacuna se realizan de acuerdo con los aspectos técnicos de la misma como: la presentación, el cronograma y las condiciones de almacenamiento establecido con las farmacéuticas para garantizar la vacunación de la población priorizada. En caso de requerir realizar alguna entrega directa desde el laboratorio productor hacia alguna entidad territorial, se informará de manera previa y se realizará la planeación en conjunto para toda la logística que se requiera”.
ARTÍCULO 2o. <Resolución derogada por el artículo 3 de la Resolución 1866 de 2021> Modificar la Resolución 1151 de 2021 en el sentido de sustituir los anexos técnicos 6 “Anexo técnico para la aplicación de la vacuna BNT162b2 Pfizer-BioNTech contra el Covid-19”, 8 “Anexo técnico para la aplicación de la vacuna del grupo CHADOX1-S/NCOV-19 (AstraZeneca) contra el Covid-19 y 10 “Anexo técnico para la aplicación de la vacuna MODERNA RNAM-1273 contra el Covid-19”.
ARTÍCULO 3o. VIGENCIA. <Resolución derogada por el artículo 3 de la Resolución 1866 de 2021> La presente resolución rige a partir de su publicación, modifica el Anexo Técnico 1, sustituye los Anexos Técnicos 6, 8 y 10 de la Resolución 1151 de 2021 y deroga la Resolución 1426 de 2021.
Publíquese y cúmplase
Dada en Bogotá, D. C., a 22 de octubre de 2021.
El Ministro de Salud y Protección Social,
Fernando Ruiz Gómez
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA BNT162B2 PFIZER-BIONTECH CONTRA EL COVID-19.
Composición.
- Es una vacuna de ARN mensajero (ARNm) monocatenario, con caperuza (CAP) en el extremo 5', que codifica la proteína S (espícula) del virus SARS-CoV-2.
- El ARNm se produce por transcripción in vitro, a partir de un modelo de ADN, en un medio acelular.
- Cada dosis de 0,3 ml contiene 30 íg de este ARNm altamente purificado incluido en nanopartículas lipídicas.
- La vacuna contiene los siguientes excipientes:
- ALC-0315=((4-hidroxibutil) azanodiil) bis (hexano-6,1-diil)bis(2-hexildecanoato) (ALC-0315)
- ALC-0159=2-[(polietilenglicol)-2000]-N, N-ditetradecilacetamida (ALC-0159)
- 1,2-diestearoil-sn-glicero-3-fosfocolina (DSPC)
- colesterol
- cloruro potásico
- fosfato dihidrogenado de potasio
- cloruro sódico
- hidrógeno fosfato disódico dihidrato
- sacarosa
- agua para inyección
Mecanismo de acción
La vacuna contra el COVID-19 denominada BNT162b2 es ARNm (ácido ribonucleico mensajero) de una sola hebra altamente purificado que contiene la secuencia genética de la proteína viral S que se encuentra en la superficie del virus SARS-CoV-2, rodeada en una envoltura lipídica (denominada nanopartícula) para permitir su transporte a las células en el cuerpo.
Cuando se inyecta, el ARNm es absorbido por las células de la persona vacunada que traducen la información genética y producen las proteínas S, activando el sistema inmunológico para que produzca anticuerpos específicos y active las células T para responder a cualquier exposición futura al unirse a la proteína S del virus SARS-CoV2 y bloquear la acción de cualquier virus que encuentre (1).
Al no contener virus vivos ni genoma completo, la vacuna no tiene capacidad replicativa y no puede producir la enfermedad. Al procesarse el ARNm directamente en el citoplasma, no se puede integrar en el genoma del huésped. Una vez entregado el mensaje y realizada la función de elaborar la proteína S el ARNm se degrada de forma natural.
Presentación, forma farmacéutica e indicación terapéutica
Presentación: vial multidosis que debe diluirse antes de su uso. 1 vial (0,45 ml) contiene 6 dosis de 30 microgramos de BNT162b2 (incrustado en nanopartículas lipídicas).
Forma farmacéutica: Concentrado para solución inyectable. La vacuna es una solución congelada de color blanco a blanquecino.
Indicaciones terapéuticas: Inmunización activa para prevenir el COVID-19 causado por el coronavirus de tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2) en personas mayores de 12 años (5).
Conservación.
- Los frascos de la vacuna congelada pueden mantenerse hasta por 6 meses a una temperatura de -70ºC y en un rango entre -15°C a -25°C por un periodo de dos semanas (15 días).
- Durante el almacenamiento se debe mantener protegido de la luz (luz solar directa y ultravioleta).
- Una vez descongelada, la vacuna sin diluir puede almacenarse hasta por 1 mes entre +2ºC y +8ºC.
- Diluida la vacuna debe usarse dentro de las 6 horas siguientes
Eficacia
La eficacia de la vacuna BNT162b2, 7 días después de la dosis 2 de la vacuna comparada con las personas que recibieron placebo (sustancia inocua diferente a la vacuna), fue de 95% (IC 95% 90.3%- 97.6%)(6).
El efecto protector de la vacuna puede verse afectado por el manejo no adecuado de la cadena de frío, técnicas inadecuadas de dilución y de aplicación.
Dosis, vía, y sitio de administración
Tabla 1
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0.3 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos |
| 2ª dosis 21 días a 12 semanas (84 días) después de aplicada la primera dosis. | que por alguna situación particular se requiera aplicar en el brazo derecho. | ||
Nota: No inyectar la vacuna por la via intravascular, subcutanea o intradermica
Administración (7).
- La vacuna DEBE mezclarse con su diluyente antes de la administración.
- La serie de vacunas de ARNm COVID-19 consta de dos dosis administradas por vía intramuscular cada una de 0,3 ml, con un intervalo de 21 días a 84 días.
- La segunda dosis de la vacuna Pfizer-BioNTech debe administrarse lo más cerca posible del intervalo recomendado; sin embargo, las segundas dosis administradas dentro de un período de gracia de 4 días antes de la fecha recomendada para la segunda dosis aún se consideran válidas.
- Si no es posible cumplir con el intervalo recomendado y es inevitable un retraso en la vacunación, la segunda dosis de la vacuna de Pfizer-BioNTech se puede administrar con un intervalo de 84 días entre primera y segunda dosis.
- Aplicar una dosis de la vacuna producida por el laboratorio Pfizer- BioNTech a población de 12 a 49 años que haya sido diagnosticada con infección por SARS-CoV-2 a través de pruebas de PCR o antígeno en un tiempo menor a 9 meses y que no tengan inmunosupresión ni las comorbilidades listadas en la numeral 8.2. resolución "Administración en personas con situaciones especiales" del Anexo 1 de esta resolución.
- Se debe mantener el esquema de 2 dosis de vacuna producida por el laboratorio Pfizer- BioNTech, en personas con inmunosupresión, de 50 años o más, mujeres gestantes, con las comorbilidades listadas en el numeral 8.2. "Administración en personas con situaciones especiales" del Anexo 1 de esta resolución y quienes han tenido la infección por SARS-CoV- 2 confirmada hace 9 meses o más.
- La población de 12 a 49 años sin comorbilidades se aplicará la segunda dosis de vacuna con un intervalo de 12 semanas (84 días). En los casos en los que la persona requiera su aplicación con un menor intervalo, esta puede ser administrada, siempre y cuando transcurran por lo menos 21 días desde la primera dosis.
- La población de 12 a 49 años con comorbilidades se aplicará la segunda dosis de vacuna con un intervalo de 21 días.
- Los errores de administración de vacunas deben informarse al sistema de notificación (ver vigilancia de ESAVI).
Si no es posible cumplir con el intervalo recomendado y es inevitable un retraso en la vacunación, la segunda dosis de las vacunas Pfizer-BioNTech COVID-19 debe administrarse lo más pronto posible.
Intercambiabilidad
La información de que se dispone sobre la intercambiabilidad de la vacuna Pfizer- BioNTech con otras vacunas de ARNm u otras plataformas de vacuna COVID-19 para completar la serie de vacunación es limitada a la fecha. La vacunación con esquemas heterólogos (productos diferentes en cada dosis del esquema) debe limitarse a personas con inmunosupresión descritas en el numeral 8.2 y a mujeres gestantes según lo descrito en el numeral 8.5 del Anexo 1.
Coadministración con otras vacunas.
- Si bien los estudios de coadministración están en curso, según el CDC, las vacunas COVID-19 y otras vacunas ahora se pueden administrar al mismo tiempo. Esto incluye la administración simultánea de vacunas COVID-19 y otras vacunas el mismo día, así como dentro de los 14 días. Se desconoce si la reactogenicidad de la vacuna COVID-19 aumenta con la coadministración, incluso con otras vacunas que se sabe que son más reactogénicas, como las vacunas con adyuvante o las vacunas vivas. Al decidir si coadministrar otra (s) vacuna (s) con las vacunas COVID-19, los proveedores deben considerar si el paciente está atrasado, en riesgo de retrasarse con las vacunas recomendadas o en alto riesgo de enfermedad prevenible por vacuna (7) (p. Ej., Durante un brote o exposiciones ocupacionales de rabia, fiebre amarilla, hepatitis B, meningococo, neumococo, influenza, entre otras. Pfizer está adelantado estudios de coadministración de esta vacuna con neumococo e influenza).
- Si se administran varias vacunas en una sola visita, administre cada inyección en un lugar diferente. Para adolescentes y adultos, el músculo deltoides puede usarse para más de una inyección intramuscular.
Preparación de la vacuna
Procedimiento para la descongelación de la vacuna
El vial multidosis se almacena en ultracongelación y debe descongelarse antes de la dilución, así:
Tabla 1. Procedimiento para la descongelación de la vacuna contra el COVID-19 laboratorio Pfizer- BioNTech
| La caja térmica contiene bandejas de 195 frascos de vacuna congelados (6 dosis cada uno). Los viales sin perforar y sin diluir se pueden almacenar en el refrigerador entre +2°C a +8°C hasta por 1 mes (30 días) Una vez abierta la caja los viales congelados deben introducirse al refrigerador para descongelarlos a una temperatura entre +2°C a +8°C*. Los viales descongelados a temperatura ambiente (hasta 25°C) deben usarse de forma inmediata. Los viales no perforados no se pueden mantener a temperatura ambiente durante más de 2 horas (incluido el tiempo de descongelación) (2). Se debe marcar cada vial con la fecha y hora de descongelación. Use las etiquetas para rastrear el tiempo de almacenamiento a temperaturas refrigeradas y congeladas (2). No vuelva a congelar la vacuna después de descongelada. Use los viales disponibles en el refrigerador antes de sacarlos de la temperatura ultracongelador o del almacenamiento en el congelador. |  |
*Una bandeja completa con 195 viales tarda 3 horas en descongelarse. Los viales individuales se descongelan en menos tiempo.
Procedimiento para la dilución de la vacuna
Para cada vial de vacuna se recomienda hacer la dilución siguiendo los siguientes pasos:
Tabla 2. Pasos para la dilución de la vacuna contra el COVID-19 laboratorio Pfizer-BioNTech
| Antes de mezclar, verifique las fechas de vencimiento de la vacuna y el diluyente. NUNCA use vacunas o diluyentes vencidos. Las fechas de vencimiento del diluyente y la vacuna se encuentran en el respectivo vial. Permita que el vial alcance la temperatura ambiente y, antes de diluir, invierta suavemente el vial 10 veces, sin agitar ni sacudir (como muestra la figura). Vigile que la vacuna se presente en forma blanquecina sin partículas visibles no blanquecinas. Nota: Ubique la vacuna en cuarentena si hay partículas o decoloración. | 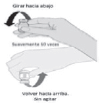 |
| 1. El vial de la vacuna una vez descongelado contiene 0,45 ml y debe diluirse en su vial original con 1,8 ml de solución inyectable de cloruro de sodio 9 mg/ml (0,9%), utilizando una aguja de calibre 21G o más estrecha y técnicas asépticas. Para reconstituir la vacuna el diluyente debe estar a temperatura ambiente o refrigerado a temperaturas entre +2°C - +8°C. El diluyente NO se debe congelar. Anote la fecha y la hora en que se mezcló la vacuna en el vial. | 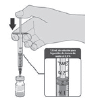 |
| 2. Una vez coloque todo el diluyente en el vial y antes de retirar la jeringa extraiga 1,8 ml de aire, para equilibrar la presión del frasco y evitar la aerosolización. | 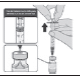 |
| 3. Invertir suavemente la solución diluida 10 veces (como se muestra en la figura). NO sacudir ni agitar. La vacuna diluida debe presentarse como una solución blanquecina sin partículas visibles. Ubique la vacuna en cuarentena si hay partículas o decoloración. | 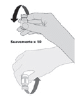 |
| 4. Los viales diluidos deben marcarse con la fecha y la hora de dilución y almacenarse entre +2°C a +8°C. usar inmediatamente y dentro de las 6 horas posteriores a la dilución. Nota: Ningún vial podrá usarse 6 horas después de la hora exacta en que se hizo la dilución. |  |
| 5. Después de la dilución, el vial contiene 6 dosis de 0,3 ml. Extraiga la dosis necesaria de 0,3 ml de vacuna diluida con una aguja y una jeringa estériles de 1ml (22G o 23G) convencional o auto descartable según disponibilidad y deseche cualquier vacuna no utilizada dentro de las 6 horas posteriores a la dilución. Mantenga la vacuna mezclada entre 2°C y 8°C, minimice la exposición a la luz ambiental y evite la exposición a la luz solar directa y ultravioleta. Administrar dentro de las 6 horas. Deseche cualquier vacuna no utilizada después de 6 horas. No vuelva a guardarlo en el congelador (2). No se extraerán fracciones de dosis de un vial para ser completadas con otro vial. Si la cantidad de vacuna que queda en el vial no es suficiente para obtener una dosis completa de 0,3 ml, se desechará el vial con el volumen sobrante. | 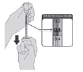 |
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
1. Reporte al coordinador del punto de vacunación su hallazgo.
2. No utilice el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal por correo electrónico indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal y/o departamental/distrital.
6. El nivel departamental/distrital reportará vía telefónica a este Ministerio a través del CNE para PAI y al correo electrónico establecido por esta Entidad
7. El Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
8. Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
Se debe contar con un seguimiento de confirmación al agendamiento y disponer de una lista de espera de manera que se garantice el uso total de la vacuna en la población priorizada de acuerdo con la etapa en la cual se está desarrollando la vacunación.
Técnica para aplicar la vacuna.
- Realice la higiene de las manos antes de la preparación de la vacuna, entre la atención de pacientes y siempre que se ensucien las manos.
- Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
- Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
- Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
- Antes de inyectar la dosis compruebe que la jeringa preparada no está fría al tacto, que contiene el volumen adecuado de 0,3 ml y que el producto no presenta partículas ni anormalidades de color (2).
- Con una mano estire la piel con los dedos pulgar e índice.
- Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
- Introduzca la aguja por vía intramuscular.
- Presione el émbolo para que penetre la vacuna.
- Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
- Estire la piel para perder la luz del orificio que dejó la aguja.
- Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
Observación post-vacunación
Durante el estudio clínico no se presentaron reacciones alérgicas graves. Sin embargo, debido a algunas reacciones alérgicas presentadas posterior al inicio de la vacunación, el fabricante recomienda que las personas vacunadas permanezcan en observación.
- Indicar a la persona vacunada, que debe permanecer en observación:
30 minutos: Personas con antecedentes de una reacción alérgica inmediata de cualquier gravedad a una vacuna o terapia inyectable y personas con antecedentes de anafilaxia por cualquier causa.
15 minutos: Todas las demás personas.
- En esta área, el personal de salud debe informarle los cuidados post-vacunación que se deben tener.
- Si durante su estancia en el área de observación, alguna persona vacunada presentara alguna molestia de tipo alérgico ya sea leve o de mayor magnitud, se contará con personal de salud capacitado para su atención y/o una ambulancia con equipo y personal idóneo; en caso de requerir tratamiento adicional, le trasladarán a una unidad de salud previamente identificada para la debida atención.
- Al terminar la estancia en el área de observación, se le entregará el carné de vacunación donde se indicará la fecha en que se aplicó la primera dosis de la vacuna y el día en que deberá acudir para la segunda dosis.
Contraindicaciones y precauciones (6).
- Son muy pocas las personas que no pueden recibir el biológico de Pfizer BioNTech.
- Donde hay duda, en lugar de retener vacunación, se debe buscar el asesoramiento adecuado del especialista pertinente o del equipo local de inmunización o protección de la salud.
- La vacuna no debe administrarse a personas que hayan tenido una reacción alérgica sistémica previa de cualquier gravedad (incluida la anafilaxia de inicio inmediato) a:
- Una dosis anterior de la misma vacuna COVID-19
- Cualquier componente (excipiente) de la vacuna COVID-19, p. Ej. Polietilenglicol (PEG).
- Un número muy pequeño de personas ha experimentado anafilaxia cuando se vacunó con el Vacuna Pfizer BioNTech. Tras una estrecha vigilancia nacional, la MHRA ya no aconseja que las personas con antecedentes de anafilaxia a cualquier vacuna, medicamento o alimento no reciban la vacuna. Cualquier persona con antecedentes de reacciones alérgicas a los componentes de la vacuna no debe recibirla, pero aquellos con cualquier otra alergia (como una alergia alimentaria) pueden recibir la vacuna.
- La vacuna de ARNm de Pfizer BioNTech contiene PEG. El PEG (también conocido como macrogoles) son un grupo de alérgenos conocidos que se encuentran comúnmente en medicamentos, muchos productos para el hogar y cosmética. Los medicamentos que contienen PEG incluyen algunas tabletas, laxantes, inyecciones de esteroides de depósito y algunas preparaciones intestinales que se usan para la colonoscopia.
- La alergia conocida a la PEG es rara, pero contraindicaría la recepción de esta vacuna. (Sellaturay P et al, 2020). No está claro si el PEG es la única causa de reacciones alérgicas en pacientes con síntomas alérgicos sistémicos después de la primera dosis de la vacuna Pfizer-BioNTech
En estos casos, tras recibir la vacunación también se mantendrá un seguimiento de 15 o 30 minutos. Ver resumen (Tabla 3).
Tabla 3. Manejo de pacientes con historia de alergia
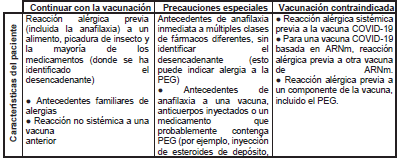
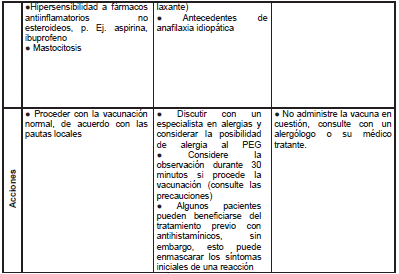
Tomado de: COVID-19: The green book, chapter 14ª (6).
Precauciones
Se han informado reacciones anafilácticas después de la administración de la vacuna BNT162b2 fuera de los ensayos clínicos.
- Riesgo de reacciones alérgicas agudas.
- Una historia de cualquier reacción alérgica inmediata a cualquier otra vacuna o terapia inyectable (intramuscular o intravenosa o vacunas intramusculares o subcutáneas) se considera una precaución, pero no una contraindicación para la vacunación.
- A estas personas, se les debe realizar una evaluación de riesgo para determinar el tipo y la gravedad de la reacción y la fiabilidad de la información; pueden recibir vacunación, pero se les debe informar la posibilidad de desarrollar una reacción alérgica, sopesando los riesgos contra los beneficios de la vacunación.
- Deben ser observadas durante 30 minutos después de la vacunación en entornos de atención médica donde una eventual reacción desde leve, hasta severa (anafilaxia) se puede tratar de inmediato.
- Dado que también se ha notificado un pequeño número de reacciones anafilácticas en vacunados sin antecedentes de reacciones alérgicas graves, la OMS recomienda que la vacuna se administre solo en entornos donde se pueda tratar la anafilaxia.
- Hasta que no haya más datos e información disponible con respecto a reacciones alérgicas a la vacunación con BNT162b2, se debe observar durante al menos 15 minutos a todos los vacunados.
- Las personas con antecedentes de enfermedad alérgica: de contacto (látex), alimentaria (huevo, gelatina, leche, frutas), respiratoria incluida el asma controlada y la rinitis, alergia a mascotas, a otros medicamentos, pueden vacunarse en los centros de vacunación dispuestos siguiendo los protocolos establecidos y el tiempo mínimo de espera en el centro de vacunación de 15 minutos inmediato a la aplicación. La enfermedad leve sin fiebre o malestar sistémico no debe posponer la vacunación.
- Si una persona se encuentra muy mal, la vacunación puede posponerse hasta que se haya recuperado por completo. Esto es para evitar confundir el diagnóstico diferencial de cualquier enfermedad aguda (incluido COVID-19) al atribuir erróneamente cualquier signo o síntoma a los efectos adversos de la vacuna.
- No hay evidencia de ningún problema de seguridad al vacunar a personas con antecedentes de infección por COVID-19 o con anticuerpos COVID-19 detectables.
- Es poco probable que la vacunación de personas que puedan estar infectadas o que estén incubando la infección por COVID-19 tenga un efecto perjudicial sobre la enfermedad, en estos casos la vacunación debe posponerse para evitar confundir el diagnóstico diferencial hasta treinta (30) días después de la fecha de inicio de síntomas en personas sintomáticas y por lo menos treinta (30) días contados desde la fecha de toma de muestra para personas asintomáticas.
- Tener síntomas de COVID-19 prolongados no es una contraindicación para recibir la vacuna COVID-19, pero si el paciente está gravemente debilitado, aún se encuentra bajo investigación activa o tiene evidencia de deterioro reciente, se puede considerar el aplazamiento de la vacunación para evitar la atribución incorrecta de cualquier cambio en la condición subyacente de la persona a la vacuna.
- Deberá disponerse del tratamiento médico adecuado para el manejo de las reacciones alérgicas inmediatas en caso de que se produzca una reacción anafiláctica aguda tras la administración de la vacuna COVID-19 de Pfizer-BioNTech.
- Deberá disponerse del tratamiento médico adecuado para el manejo de las reacciones alérgicas inmediatas en caso de que se produzca una reacción anafiláctica aguda tras la administración de la vacuna COVID-19 de Pfizer-BioNTech.
- Tener precaución con pacientes con antecedentes de reacciones alérgicas severas de tipo anafilaxia o angioedema.
- Monitorear a los destinarios de la vacuna COVID-19 de Pfizer-BioNTech por la ocurrencia de reacciones adversas inmediatas de acuerdo con las directrices del Ministerio de Salud y Protección Social.
- Alteración de la inmunocompetencia. Las personas inmunocomprometidas, incluyendo individuos que reciben tratamiento inmunosupresor, pueden tener una respuesta inmune disminuida a la vacuna COVID-19 de Pfizer-BioNTech.
- Limitación de la eficacia. La vacuna COVID-19 de Pfizer-BioNTech puede no proteger a todos los vacunados.
Advertencias.
- Cualquier persona con una enfermedad febril aguda (temperatura corporal superior a 38,5 ºC) debe posponer la vacunación hasta que esté afebril.
- Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
- Como sucede con otras inyecciones intramusculares, la vacuna debe administrarse con precaución a las personas que reciban tratamiento anticoagulante o a aquellas que presenten trombocitopenia o padezcan un trastorno de la coagulación (como hemofilia) debido a que en estas personas se puede producir sangrado o formación de hematomas tras una administración intramuscular.
- Las personas inmunodeprimidas, incluidas las personas que reciben terapia inmunosupresora, pueden tener una respuesta inmunitaria disminuida a la vacuna. No hay datos disponibles sobre el uso concomitante con inmunosupresores.
- Como con cualquier vacuna, la vacunación con la vacuna BNT162b2 puede no proteger a todos los receptores de la vacuna.
- No se dispone de datos sobre el uso de la vacuna de BNT162b2 en personas que hayan recibido previamente una serie de vacunas completa o parcial con otra vacuna de COVID-19.
- Información sobre el excipiente: Esta vacuna contiene potasio, menos de 1 mmol (39 mg) por dosis, es decir, esencialmente "libre de potasio". Esta vacuna contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, esencialmente "libre de sodio".
- La vacuna no se debe aplicar en personas que recientemente hayan presentado COVID-19 y aun no se recuperen.
- Personas con inmunosupresión severa por cualquier causa (incluye personas con VIH no controlado), pueden vacunarse, aunque la respuesta inmunológica por su estado podría no garantizar la eficacia demostrada de la vacuna.
- Las personas con antecedente de COVID-19 confirmado, en el marco del Plan Nacional de Vacunación contra el COVID-19 serán vacunadas treinta (30) días contados después de inicio de síntomas en personas sintomáticas o treinta (30) días después de la toma de muestra en personas asintomáticas.
Fertilidad, embarazo y lactancia.
- Embarazo: Ver Consideraciones respecto a la vacunación de gestantes ítem 8.5 del Anexo 1.
- Lactancia: Se espera que la eficacia de la vacuna sea similar en mujeres lactantes que en otros adultos. Como la vacuna BNT162b2 no es de virus vivo y el ARNm no ingresa al núcleo de la célula y se degrada rápidamente en el citoplasma de las células, es biológica y clínicamente poco probable que represente un riesgo para el niño que amamanta. Sobre la base de estas consideraciones, una mujer lactando, que forma parte de un grupo recomendado para la vacunación, por ejemplo, a los trabajadores de la salud, se les debe ofrecer la vacunación sopesando riesgo beneficio.
La OMS recomienda continuar con la lactancia materna después de la vacunación ver: https://www.who.int/news-room/events/detail/2021/01/05/default-calendar/extraordinary-meeting-of-the-strategic-advisory-group-of-experts-on-immunization-(sage)---5-january-2021.
- Fertilidad: Están en curso los estudios de toxicidad reproductiva en líneas de investigación en animales.
Reacciones adversas esperadas
En los estudios clínicos, las reacciones adversas en los participantes a partir de los 16 años y mayores incluyen dolor en el lugar de la inyección (84,1%), fatiga (62,9%), cefalea (55,1%), dolor muscular (38,3%), escalofríos (31,9%), dolor articular (23,6%), fiebre (14,2%), inflamación en el lugar de la inyección (10,5%), enrojecimiento en el lugar de la inyección (9,5%), náuseas (1.1%), malestar general (0.5%) y linfadenopatía (0,3%).
En un estudio clínico, las reacciones adversas en adolescentes de 12 a 15 años incluyeron dolor en el lugar de la inyección (90,5%), fatiga (77,5%), cefalea (75,5%), escalofríos (49,2%), dolor muscular (42,2%), fiebre (24,3%), dolor articular (20,2%), inflamación en el lugar de la inyección (9,2%), enrojecimiento del lugar de la inyección (8,6%), linfadenopatía (0,8%) y náuseas (0,4%).
Se han reportado reacciones alérgicas graves tras la administración de la vacuna COVID-19 de Pfizer- BioNTech durante la vacunación en masa fuera de los estudios clínicos. La información de experiencia en estudios clínicos puede ser consultada en la Información para prescribir (IPP).
En caso de sobredosis
Los participantes que recibieron 58 microgramos de la vacuna BNT162b2 en ensayos clínicos no informaron un aumento en la reactogenicidad o eventos adversos.
En caso de sobredosis: >0,3 ml, se recomienda la monitorización de las funciones vitales y el posible tratamiento sintomático.
Interacción con otros medicamentos y otras formas de interacción.
- No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna de BNT162b2 con otras vacunas.
- No mezclar la vacuna BNT162b2 con otras vacunas / productos en la misma jeringa.
Efectos sobre la capacidad para conducir y utilizar máquinas
La vacuna BNT162b2 tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas pueden afectar temporalmente a la capacidad para conducir o utilizar máquinas.
Vacunación segura
Antes de recibir la vacuna BNT162b2 debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si usted:
- Tiene alguna alergia. Es importante indagar al usuario en dos momentos; (i) Agendamiento de cita y (ii) Firma de consentimiento informado sobre su historial alérgico (Center for Disease Control and Prevention (CDC). Morbidity and Mortality Weekly Report (MMWR) Allergic Reactions Including).
- Tiene fiebre.
- Tiene un trastorno hemorrágico o está tomando un anticoagulante.
- Está inmunocomprometido o está tomando un medicamento que afecta a su sistema inmunológico.
- Ha recibido otra vacuna contra el COVID-19.
- En caso de ser mujer en edad reproductiva preguntar:
- Está embarazada o planea quedar embarazada
- Está amamantando.
- Si el usuario solicita su segunda dosis: verifique el carné de vacunación. Si no lo trae, proceda a verificar en el PAIWEB el tipo de vacuna que se aplicó en su primera dosis, antes de pasarlo al paso de ruta de la aplicación de la vacuna.
(Hoja informativa para receptores y proveedores de cuidado autorización de uso de emergencia (EUA, por sus siglas en inglés) de la vacuna contra el COVID-19 de Pfizer-BioNTech para prevenir la enfermedad del coronavirus 2019 (covid-19) en personas de 16 años y mayores. https://www.in.gov/isdh/files/Recipient Fact Sheet Spanish.pdf)
Nota: Ver ítem contraindicaciones.
Vigilancia de eventos supuestamente atribuidos a vacunación o inmunización (ESAVI)
Para cumplir con los lineamientos de vacunación segura con esta vacuna, como con cualquiera de las otras incluidas en el esquema nacional, se deberá garantizar la notificación y seguimiento a las reacciones adversas que se presenten en la población después de la administración, tomando como referencia el protocolo de vigilancia en Salud Pública de los ESAVI GRAVE - Código 298 del Instituto Nacional de Salud disponible en el siguiente enlace: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
Se debe socializar la ficha de notificación de eventos adversos seguidos a la vacunación o inmunización ESAVI (ficha 298) con todas las IPS, ESE y equipos de vacunadores para su adecuado diligenciamiento y entrega a los supervisores directos. Disponible en: https://www.ins.gov.co/buscador-eventos/Lineamientos/298_EAPV_2021.pdf
Es importante mencionar que, para efectos de la vigilancia en salud pública, los eventos que deberían ser notificados son aquellos que cumplen con la definición operativa de caso: Persona que presenta cualquier signo, síntoma, trastorno o síndrome después de la administración de una vacuna, que cause una incapacidad, discapacidad, ponga en riesgo la vida, requiera hospitalización u ocasione la muerte, o genere clúster de eventos graves y que, la persona, sus cuidadores o los trabajadores de la salud consideren que podría atribuirse a la vacunación o proceso de inmunización (32).
Los casos deben ser ingresados mediante la ficha de notificación de eventos adversos seguidos a la vacunación o inmunización ESAVI (ficha 298).
Fuentes de información:
1. Public Health England. COVID-19 vaccination guidance for healthcare practitioners. [Internet]. Última actualización: 31 de diciembre de 2020. [cited 2021 Apr 10]. Available from: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/965177/C OVID-19_vaccination_programme_guidance_for_healthcare_workers_26_February_2021_v3.4.pdf
2. CDC. 20 de mayo. Pfizer-BioNTech COVID-19 Vaccine. Vaccine Preparation and Administration Summary [Internet]. 2021. Available from: https://www.cdc.gov/vaccines/covid-19/info-by-product/pfizer/downloads/prep-and-admin-summary.pdf
3. Pfizer BioNTech. Fact sheet for recipients and caregivers Interim authorization of the Pfizer-BioNTech Covid- 19 vaccine to prevent coronavirus disease 2019 (Covid-19) in individuals 12 years of age and older. [Internet]. 2021 [cited 2021 May 24]. p. 1–5. Available from: https://www.hsa.gov.sg/docs/default-source/hprg-tpb/guidances/pfizer_biontech_covid19_fact_sheet_for_recipients.pdf
4. Frenck RW, Klein NP, Kitchin N, Gurtman A, Absalon J, Lockhart S, et al. Safety, Immunogenicity, and Efficacy of the BNT162b2 Covid-19 Vaccine in Adolescents. N Engl J Med [Internet]. 2021;1–12. Available from: http://www.ncbi.nlm.nih.gov/pubmed/34043894
5. Invima. Resolución 2021025659 del 24 de junio de 2021. Por la cual se modifica la ASUE para la vacuna Pfizer BioNTech Covid-19 vaccine. 2021;
6. COVID-19: the green book chapter 14a. Coronavirus (COVID-19) vaccination information for public health professionals. Public Health England.
7. Centers for Disease Control Prevention. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States [Internet]. 2021 [cited 2021 Jan 18]. Available from: https://www.cdc.gov/vaccines/covid-19/info-by-product/clinical-considerations.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fvaccines%2Fcovid-19%2Finfo-by-product%2Fpfizer%2Fclinical-considerations.html#Administration
8. ECDC Technical Report. Overview of EU/EEA country recommendations on COVID-19 vaccination with Vaxzevria, and a scoping review of evidence to guide decision-making Key messages Background Vaccine roll-out in the EU/EEA. (May). Available from: https://www.ecdc.europa.eu/en/publications-data/overview-eueea-country-recommendations-covid-19-vaccination-vaxzevria-and-scoping
9. Warshawsky B, Salvadori M, Baclic O, Nam A, Yeung M, Ximenes R, et al. Extended dose intervals for COVID- 19 vaccines to optimize early vaccine rollout and population protection in Canada in the context of limited vaccine supply. Canada Heal - NACI [Internet]. 2021; Available from: https://www.canada.ca/en/public-health/services/immunization/national-advisory-committee-on-immunization-naci/extended-dose-intervals-covid-19-vaccines-early-rollout-population-protection.html
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA DEL GRUPO CHADOX1-S/NCOV-19 (ASTRAZENECA) CONTRA EL COVID-19 (1).
Composición.
- Vacuna monovalente compuesta por un vector de adenovirus de chimpancé no replicativo (ChAdOx1) producido mediante técnicas de recombinación de ADN, que expresa la proteína S (espícula) del SARS-CoV-2.
- Cada dosis de 0,5 ml contiene al menos de 5x1010 de unidades infectivas de adenovirus de chimpancé que codifica la proteína S (espícula) del virus SARS-CoV-2.
- La vacuna contiene los siguientes excipientes: L-Histidina, Hidrocloruro de L-histidina monohidrato, Cloruro de magnesio hexahidratado, Polisorbato 80 (E 433), Etanol, Sacarosa, Cloruro de sodio, Edetato disódico (dihidrato), Agua para preparaciones inyectables.
Mecanismo de acción
Las vacunas contra la COVID-19 del grupo ChAdOx1-S son vacunas de vector viral. Los vectores virales se han utilizado para el desarrollo de vacunas durante varias décadas y se caracterizan por una fuerte respuesta de linfocitos CD4 + y CD8 +, incluso en ausencia de un adyuvante, lo que los convierte en un vector de vacuna adecuado para virus patógenos que provocan una fuerte respuesta inmune celular (2,3), utilizando adenovirus humanos (por ejemplo: Ad5, Ad26), adenovirus de origen animal u otros virus para producir vacunas (4).
Las vacunas fueron elaboradas a partir de la modificación genética de un adenovirus recombinante ChAd, que no posee envoltura, es no replicativo y se cultiva en la línea celular humana (HEK293). ChAd, causa resfriado común en los chimpancés, pero no causa enfermedades en humanos y es capaz de expresar la proteína S (espícula) del SARS-CoV-2, coronavirus que causa la COVID-19 (5).
Cuando se inyecta la vacuna, el adenovirus modificado se une a la superficie de las células humanas y entrega el código genético de la proteína S. Las células procesan y fabrican la proteína S que estimula el sistema inmunológico para producir anticuerpos y células de memoria contra el virus SARS-CoV-2 sin causar enfermedad (5). Los anticuerpos frente al vector generados tras la primera dosis no parecen influir en la respuesta humoral a la segunda dosis de la misma vacuna, pero sí en la respuesta celular. Los anticuerpos IgG producidos frente a S, anticuerpos neutralizantes y respuesta de células T con IFNã en todos los participantes tras la segunda dosis, no mostraron interferencia entre la inmunidad previa anti-vector y la respuesta inmune a la primera y a la segunda dosis (6,7).
Presentación, forma farmacéutica e indicación terapéutica
Presentación:
- Caja que contiene 10 viales multidosis.
- El vial es de vidrio transparente con tapón elastomérico y sello de aluminio que contiene 5 ml de suspensión para 10 dosis de 0.5 ml o de 4 ml de suspensión para 8 dosis de 0.5 ml. (8).
- Una dosis (0,5 ml) contiene adenovirus que codifica la proteína S del SARS-CoV-2 (ChAdOx1- S/nCoV-19), no menos de 5 × 1010 partículas virales (dosis estándar) (8,9).
- Se incluye un sobrellenado adicional en cada vial para asegurar que se puedan administrar las 10 dosis (vial de 5 ml) de 0,5 ml. Es normal que permanezca líquido en el vial después de retirar la dosis final. No acumule el exceso de vacuna de varios viales y deseche el sobrante según el protocolo respectivo.
Forma farmacéutica: Suspensión inyectable vial de 10 dosis, 0.5 ml por dosis. La suspensión es incolora a ligeramente opalescente.
Indicaciones terapéuticas: Inmunización activa para prevenir la COVID-19 causado por el virus del SARS-CoV-2, en personas de 18 años o más. El uso de esta vacuna debe estar de acuerdo con las recomendaciones del fabricante.
Conservación
- Vial sin abrir: 6 meses cuando se conserva en nevera (+2°C - +8°C) en su envase y empaque original.
- Vial abierto: Hasta 6 horas después de la apertura (10,11).
- Después del período de tiempo descrito anteriormente, el producto debe desecharse. No lo devuelva al refrigerador.
- Desde un punto de vista microbiológico, después de la primera apertura, la vacuna debe usarse inmediatamente.
- Si la vacuna no se usa inmediatamente, en los tiempos y las condiciones de conservación descritas anteriormente, el uso es responsabilidad del prestador.
Nota: Conservar los viales en el embalaje exterior para protegerlos de la luz.
Manejo.
- Esta vacuna debe ser manipulada por un profesional sanitario utilizando una técnica aséptica para garantizar la esterilidad de cada dosis.
- No utilice esta vacuna después de la fecha de caducidad que aparece en la etiqueta. La fecha de vencimiento se refiere al último día de ese mes.
- El vial multidosis sin abrir debe conservarse en nevera (entre 2 °C y 8 °C). No congelar.
- La vacuna debe inspeccionarse visualmente para detectar partículas y decoloración antes de su administración.
- Deseche el vial si la suspensión se decolora o se observan partículas visibles.
- No sacuda ni diluya la suspensión.
Intercambiabilidad
No hay datos disponibles sobre la intercambiabilidad de la vacuna Oxford-AstraZeneca AZD1222 (ChAdOx1-S/nCoV-19) con otras vacunas COVID-19 para completar el esquema de vacunación.
- Todas las vacunas del grupo ChAdOx1-S cubiertos en esta presentación (AstraZeneca AZD1222- Vaxzevria, Serum Institute India (SII) Covishield y SK Bioscience) se consideran equivalentes e intercambiables para ambas dosis.
- La OMS recomienda que ambas dosis se administren con productos ChAdOx1-S (12,13). Ambas dosis de la serie son necesarias para la protección y deben completarse con cualquiera de las vacunas del grupo ChAdOx1-S.
- Algunos países de la Unión Europea (14) han decidido restringir el uso de los productos del grupo ChAdOx1-S a grupos de edad específicos y/o esperar pruebas para orientar las decisiones futuras sobre la vacunación completa (y la protección efectiva contra COVID-19) para aquellos que hayan recibido la primera dosis. Por lo tanto, la evidencia disponible se ha evaluado frente a las siguientes opciones para la administración de la segunda dosis (14):
1. Segunda dosis de productos del grupo ChAdOx1-S para todas las personas que recibieron una primera dosis productos del grupo ChAdOx1-S: Está aprobada, cuenta con la mayor evidencia, sigue las recomendaciones del productor, no hay datos para hacer un cambio en las recomendaciones actuales, continúan las investigaciones acerca del TTS después de la 2da dosis.
2. Segunda dosis con una vacuna de ARNm según calendario: Actualmente, esta opción no está respaldada por la evidencia disponible. Estudios en curso en estados miembros de la Unión Europea.
3. Segunda dosis con otra vacuna basada en adenovirus como vector: Hasta el momento, no hay datos sobre la inmunogenicidad, seguridad y eficacia del uso de otra vacuna COVID-19 basada en vector de adenovirus como segunda dosis en un esquema mixto.
4. No se administra ninguna dosis adicional: No está autorizado para un régimen de dosis única y está indicado para ser administrado como dos dosis estándar que proporcione una protección completa y a largo plazo contra COVID-19. No hay evidencia que respalde esta opción.
- Estas opciones pueden aplicarse en situaciones en las que las autoridades nacionales han emitido una recomendación sobre el uso de las vacunas del grupo ChAdOx1-S a determinadas edades o grupos de población, o cuando se haya tomado la decisión de retrasar la segunda dosis más allá del intervalo de tiempo recomendado
Eficacia.
- Las vacunas del grupo ChAdOx1-S tienen una eficacia del 70,4% (15,16) contra la infección sintomática por SARS-CoV-2, como lo muestra el análisis primario en participantes del ensayo en el Reino Unido, Brasil y Sudáfrica que recibieron 2 dosis estándar.
- Datos de análisis intermedios del ensayo de fase 3 realizado en los Estados Unidos donde se reclutó a 32.449 participantes, de los cuales el 22% de la población del ensayo era de 65 años o más. El análisis primario incluyó eventos a partir de los 15 días posteriores a la segunda dosis, aplicada con un intervalo entre dosis de 28 días. La eficacia de la vacuna contra la infección sintomática por SARS-CoV-2 fue del 76% (IC del 95%: 68–82%). No se produjeron casos graves o críticamente enfermos en el grupo vacunado y se reportaron 8 casos en el grupo de placebo. La eficacia de la vacuna en los participantes del ensayo de 65 años o más fue del 85% (IC del 95%: 58-94%) (17).
- En los participantes entre 18 y 55 años que recibieron dos dosis estándar, después de la segunda dosis, la eficacia fue mayor en aquellos con un intervalo de refuerzo más prolongado.12 semanas (eficacia de la vacuna 81,3% [IC 95% 60,3–91,2]) que en aquellos con un intervalo corto <6 semanas (eficacia de la vacuna 55,1% [33,0–69,9]. Estas observaciones están respaldadas por datos de inmunogenicidad que mostraron respuestas de anticuerpos de más del doble después de una intervalo de 12 semanas o más en comparación con un intervalo de menos de 6 semanas (10, 18, 19).
- Los resultados presentados en participantes a partir de 18 años señalan que se encontraron 64 casos confirmados de COVID-19 en el grupo vacunado y 154 casos en el grupo control, 15 días después de la 2ª dosis. La eficacia en participantes sin evidencia de infección previa por SARS-CoV-2, en los que se administró con un intervalo entre dosis de 4 a 12 semanas, fue del 59,5% (IC95%: 45,8%-69,7%).
- El 9,8% de los participantes tenían 65 años o más, entre los cuales hubo 12 casos de COVID- 19; 4 en los grupos de vacuna y 8 en el grupo de control (VE = 51,91%; IC del 95%: -59,98% a 85,54 %), 15 días después de la segunda dosis de vacuna (16).
- La eficacia en participantes con una o más comorbilidades fue del 58,3% (IC95%: 33,6%-73,9%), detectándose 25 y 60 casos de COVID-19 en los grupos vacunados (N=2.068) y control, (N=2.040) respectivamente(19).
Dosis, vía, y sitio de administración
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del |
| 2ª dosis De 4 semanas (28 días) a 12 semanas (84 días) después de aplicada la primera dosis. | brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. | ||
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Administración.
- La serie de vacunas del grupoChAdOx1-S consta de dos dosis de 0,5ml cada una, administradas por vía intramuscular preferiblemente en el músculo deltoides de la parte superior del brazo.
- Las personas que hayan recibido la primera dosis de las vacunas del grupo ChAdOx1-S deben recibir la segunda dosis de una de las vacunas del grupo ChAdOx1-S de la presentación: AstraZeneca AZD1222, SII Covishield y SK Bioscience, considerados equivalentes e intercambiables en ambas dosis para completar el esquema (12,13).
- La segunda dosis puede aplicarse con un intervalo de cuatro (4) a doce (12) semanas.
- Los errores de administración de vacunas deben informarse al sistema de vigilancia. (ver vigilancia de ESAVI).
Si no es posible cumplir con el intervalo recomendado y es inevitable un retraso en la vacunación, la segunda dosis de las vacunas del grupo ChAdOx1-S, esta debe administrarse lo más pronto posible.
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
- Reporte al coordinador del punto de vacunación su hallazgo.
- No utilice el vial, sepárelo y márquelo como cuarentena.
- Realice un video del vial, evidenciando su hallazgo.
- Realice el reporte al coordinador municipal, por correo electrónico indicando lote y el fabricante para cada uno de los biológicos del grupo ChAdOx1-S, envíe la evidencia.
- Reporte al nivel municipal y/o departamental/distrital.
- El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin.
- El Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
- Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
Al finalizar la jornada diaria se debe verificar el número de dosis sobrantes por vial multidosis abierto, éstas deben ser las primeras dosis del vial usadas al día siguiente. Para este caso el vial multidosis abierto ha demostrado estabilidad química y física en uso desde el momento de la perforación del vial hasta la administración por un tiempo no mayor de 6 horas almacenado a temperatura no mayor a 30°C o 48 horas almacenado en un refrigerador (2 a 8°C).
Es importante mencionar que todas las personas a vacunar estén agendadas o no, deben seguir todo el proceso de vacunación, que incluye entre otros, diligenciar y firmar del consentimiento informado, recibir la información relacionada con la vacuna, permanecer el tiempo asignado en las instalaciones posterior a la vacunación según su condición, registrar la información en el PAIWEB y recibir el carné de vacunas.
Técnica para aplicar la vacuna.
- Antes, durante y después de la vacunación, todas las personas deben seguir las pautas actuales para la protección contra COVID-19 en su área (por ejemplo, usar tapabocas, mantener la distancia física, higiene de manos) (20).
- Una persona que presente síntomas de COVID-19 no debe vacunarse. Se puede ofrecer la vacuna a las personas que se hayan recuperado de la COVID-19 sintomático o asintomático (20).
- Realice higiene de manos.
- Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
- Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
- Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
- Con una mano estire la piel con los dedos pulgar e índice.
- Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
- Introduzca la aguja por vía intramuscular.
- Presione el émbolo para que penetre la vacuna.
- Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
- Estire la piel para perder la luz del orificio que dejó la aguja.
- Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
- Al concluir el procedimiento realice la higiene de manos.
Observación post-vacunación
Durante el estudio clínico no se informaron reacciones de hipersensibilidad. Sin embargo, la OMS (10) y el fabricante (1) recomiendan que las personas vacunadas permanezcan en observación por lo menos 15 minutos.
- Indicar a la persona vacunada, que debe permanecer en observación:
30 minutos: personas con antecedentes de una reacción alérgica inmediata de cualquier gravedad a una vacuna o terapia inyectable y personas con antecedentes de anafilaxia por cualquier causa.
15 minutos: todas las demás personas.
En esta área, el personal de salud debe informarle los cuidados post-vacunación que se deben tener.
Si durante su estancia en el área de observación, alguna persona vacunada presentara alguna molestia de tipo alérgico ya sea leve o de mayor magnitud, se contará con personal de salud capacitado para su atención y/o una ambulancia con equipo y personal idóneo; en caso de requerir tratamiento adicional, le trasladarán a una unidad de salud previamente identificada para la atención. Al terminar la estancia en el área de observación, se le entregará el carné de vacunación donde se indicará la fecha en que se aplicó la primera dosis de la vacuna y el día en que deberá acudir para la segunda dosis.
Coadministración con otras vacunas.
- Debe haber un intervalo mínimo de 14 días entre la administración de esta vacuna y cualquier otra vacuna contra otras enfermedades hasta que se disponga de datos sobre coadministración con otras vacunas (10,20).
- Se debe priorizar la vacunación contra la COVID-19.
- En jornada de vacunación contra la influenza se puede vacunar 14 días antes o después de haber recibido cualquiera de las vacunas del grupo ChAdOx1-S.
Contraindicaciones.
- Hipersensibilidad al principio activo o a alguno de los excipientes.
- No debe administrarse una segunda dosis de la vacuna a personas que hayan presentado una reacción de hipersensibilidad grave (de tipo anafiláctico) a una dosis previa de la vacuna.
La vacunación debe posponerse temporalmente en personas con enfermedad aguda grave, pero una enfermedad leve sin fiebre o sin afectación sistémica no es una razón válida para posponer la vacunación.
Advertencias y precauciones especiales (21)
Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
En el trámite para la obtención de la Autorización de Uso de Emergencia (ASUE) la compañía farmacéutica AstraZeneca presentó al INVIMA documentos relacionados con la seguridad del medicamento biológico en donde se establece dentro de las advertencias y precauciones lo siguiente "(...) se debe administrar con precaución en personas con trombocitopenia, cualquier trastorno de coagulación, o a personas que están recibiendo tratamiento de anticoagulación, debido a que puede ocurrir sangrado o formación de hematomas después de una administración intramuscular" (22).
El Invima como autoridad sanitaria acoge las recomendaciones de la OMS y la Agencia Europea de Medicamentos, razón por la cual se solicitó a la farmacéutica que incluya dentro de la información aportada para la Autorización de Uso de Emergencia, la posible presentación de este tipo de eventos adversos. Todo lo anterior dado que se mantiene el balance riesgo - beneficio favorable a la aplicación de la vacuna. De igual forma, el Ministerio de Salud y Protección Social, el Invima y el Instituto Nacional de Salud, trabajan de manera articulada en la vigilancia y seguimiento de cualquier evento adverso presentado posterior a la vacunación, por medio de los reportes a través de los sistemas de notificación: Sivigila (para eventos graves) y VigiFlow (para eventos leves) (22).
Trazabilidad
Para mejorar la trazabilidad de los medicamentos biológicos, se debe registrar claramente el nombre, número de lote y el fabricante de cada uno de los biológicos del grupo ChAdOx1-S administrado. Hipersensibilidad y anafilaxia.
- No se registraron reacciones alérgicas o anafilaxia por la vacuna en el contexto de los ensayos clínicos. En caso de que se produzca un episodio anafiláctico después de la administración de la vacuna, siempre debe estar disponible el tratamiento y la supervisión médica adecuada. Se recomienda una estrecha observación durante al menos 15 minutos después de la vacunación.
- No se debe administrar una segunda dosis de la vacuna a quienes hayan experimentado anafilaxia a la primera dosis con las vacunas del grupo ChAdOx1-S.
Reacciones relacionadas con la ansiedad
Las reacciones relacionadas con la ansiedad, incluidas las reacciones vasovagales (síncope), la hiperventilación o las reacciones relacionadas con el estrés pueden ocurrir en asociación con la vacunación como una respuesta psicógena a la inyección con aguja. Es importante que se tomen precauciones para evitar lesiones por desmayos.
Enfermedad concurrente
La vacunación debe posponerse en personas que padecen una enfermedad febril aguda grave o una infección aguda. Sin embargo, la presencia de una infección leve y/o febrícula no debe retrasar la vacunación.
Trombocitopenia y trastornos de la coagulación
Al igual que con otras inyecciones intramusculares, la vacuna debe administrarse con precaución en personas que reciben terapia anticoagulante o aquellas con trombocitopenia o cualquier trastorno de la coagulación (como hemofilia) porque pueden producirse hemorragias o hematomas después de una administración intramuscular en estas personas. Ver numeral 8.4. "Consideraciones respecto a la vacunación de pacientes con antecedente de desórdenes de la coagulación o anticoagulados" del Anexo 1 de esta resolución.
Se ha observado muy raramente una combinación de trombosis y trombocitopenia, en algunos casos acompañada de hemorragia, tras la vacunación con las vacunas del grupo ChAdOx1-S. Esto incluye casos graves que se presentan como trombosis venosa, incluyendo localizaciones inusuales como la trombosis de senos venosos cerebrales, trombosis de la vena mesentérica, así como trombosis arterial, concomitantes con trombocitopenia. La mayoría de estos casos ocurrieron dentro de los primeros siete a catorce días después de la vacunación y se produjeron en mayor número en mujeres menores de 55 años de edad; sin embargo, esto puede reflejar el mayor uso de la vacuna en esta población. Algunos casos tuvieron un desenlace fatal (19).
El 21 de abril de 2021, Brighton Collaboration publicó una definición de caso provisional para estas enfermedades tromboembólicas eventos asociados con trombocitopenia como "Trombosis con síndrome de trombocitopenia" (TTS). El propósito de la definición de caso provisional es estandarizar la identificación de los casos que deben ser investigados utilizando un protocolo armonizado (23,24).
Los factores de riesgo y el mecanismo biológico del TTS aún se están investigando. Hasta la fecha, no se ha encontrado evidencia de un mayor riesgo o de cualquier otro factor de riesgo para las personas con trastornos de la coagulación o plaquetas. Un estudio publicado recientemente resume las características clínicas y de laboratorio de 11 pacientes en Alemania y Austria que desarrollaron TTS después de la vacunación. Los autores concluyeron que la vacunación con ChAdOx1-S puede resultar en el raro desarrollo de trombocitopenia trombótica inmune, mediada por anticuerpos activadores de plaquetas contra PF4, que simula clínicamente la trombocitopenia autoinmune inducida por heparina. Los hallazgos pueden tener implicaciones clínicas, en términos de conocimiento de los efectos adversos, ensayos para la investigación de casos potenciales y para el tratamiento (25). Estudios adicionales de Noruega y el Reino Unido también han encontrado anticuerpos contra PF4 en la mayoría de los pacientes que desarrollaron TTS después de la vacunación (26,27).
El personal de salud debe estar alerta a los signos y síntomas de tromboembolismo o trombocitopenia. Los vacunados deben ser informados para que busquen atención médica inmediata si desarrollan síntomas como dificultad para respirar, dolor en el pecho, inflamación de las piernas, dolor abdominal persistente después de la vacunación. Además, cualquier persona que después de la vacunación, presente síntomas neurológicos, como dolores de cabeza intensos o persistentes o visión borrosa o que experimente múltiples pequeños hematomas en la piel (petequias) en un lugar diferente al de la vacunación después de unos días, debe buscar atención médica inmediata (19,28).
La OMS emitió unas consideraciones sobre los eventos trombóticos posteriores a la administración de la vacuna de AstraZeneca contra COVID-19 en Europa, en su trabajo coordinado con la Agencia Europea de Medicamentos (EMA). Tomando en cuenta que los beneficios de la vacuna superan los riesgos, la OPS/OMS recomienda a todos los países que continúen utilizando la vacuna de AstraZeneca para enfrentar la COVID-19 mientras se investigan los eventos mencionados; además de continuar el seguimiento de la seguridad de todas las vacunas contra la COVID-19 fomentando la notificación e investigación de presuntos eventos adversos (28,29). Individuos inmunodeprimidos.
- No se ha evaluado la eficacia, seguridad e inmunogenicidad de la vacuna en personas inmunodeprimidas, incluidas las que reciben terapia inmunosupresora. La eficacia de la vacuna Oxford-AstraZeneca AZD1222 (ChAdOx1-S/nCoV-19) puede ser menor en individuos inmunosuprimidos.
- Sin embargo, si forman parte de un grupo recomendado para la vacunación, pueden vacunarse, dado que la vacuna no es de virus replicativo. Se debe proporcionar información y, cuando sea posible, asesoramiento sobre la seguridad y los perfiles de eficacia de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y los beneficios.
- Las personas con enfermedades autoinmunes que no tienen contraindicaciones para la vacunación pueden vacunarse.
- Las personas VIH positivas que estén bien controladas con terapia antirretroviral de gran actividad y que formen parte de un grupo recomendado para la vacunación pueden vacunarse, dado que la vacuna no se replica. No es necesario realizar pruebas de infección por VIH antes de la administración de la vacuna (20).
Anticuerpos monoclonales o plasma (20)
Las personas que han recibido anticuerpos monoclonales o plasma de convalecencia como parte del tratamiento con COVID-19, la vacunación debe posponerse durante al menos 90 días para evitar la interferencia del tratamiento con la respuesta inmune inducida por la vacuna.
Duración de la protección
Se desconoce la duración de la protección que brinda la vacuna, ya que aún está siendo determinada por ensayos clínicos en curso.
Limitaciones de la efectividad de la vacuna.
- La protección comienza aproximadamente 3 semanas después de la primera dosis de la vacuna Oxford-AstraZeneca AZD1222 (ChAdOx1-S/nCoV-19). Es posible que las personas no estén completamente protegidas hasta 15 días después de la administración de la segunda dosis.
- Como ocurre con todas las vacunas, la inmunización con el biológico de Oxford-AstraZeneca AZD1222 (ChAdOx1-S/nCoV-19) puede no proteger a todos los receptores de la vacuna
- Para personas mayores de 65 años, teniendo en cuenta la totalidad de la evidencia, la vacunación se recomienda ya que la respuesta inmune en las personas mayores está bien documentada y es similar a las de otros grupos de edad (20).
Interacción con otros medicamentos, otras formas de interacción e incompatibilidades.
- No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna del grupoChAdOx1-S con otras vacunas.
- No mezclar las vacunas ChAdOx1-S con otras vacunas / productos en la misma jeringa.
- Este medicamento no debe mezclarse con otros medicamentos ni diluirse.
Fertilidad, embarazo y lactancia (1,10)
Fertilidad.
- Los estudios en animales no indican efectos nocivos directos o indirectos con respecto a la toxicidad reproductiva.
- Los estudios en animales de toxicidad potencial para la reproducción y el desarrollo aún no se han completado (15).
Embarazo.
- Los datos disponibles sobre la administración de las vacunas del grupo ChAdOx1-S en mujeres embarazadas son insuficientes para evaluar la eficacia de la vacuna y / o informar los riesgos asociados con la vacuna durante el embarazo
- Según los resultados del estudio preliminar, no se esperan efectos sobre el desarrollo del feto.
- Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según un estudio convencional de toxicidad por dosis repetidas. Sin embargo, no se han concluido estudios de toxicidad en animales.
- No se realizaron estudios de genotoxicidad ni carcinogenicidad. No se espera que los componentes de la vacuna tengan potencial genotóxico.
- Un estudio preliminar de toxicidad reproductiva en ratones no muestra toxicidad en madres o fetos.
- Las gestantes deben recibir vacunas del grupo ChAdOx1-S solo si el beneficio de la vacunación para la mujer embarazada supera los riesgos potenciales de la vacuna, como si son trabajadores de la salud con alto riesgo de exposición o si tienen comorbilidades que las colocan en un grupo de alto riesgo para COVID-19 severo.
- Las vacunas del grupo ChAdOx1-S es una vacuna que no se replica (20).
- La OMS no recomienda las pruebas de embarazo antes de la vacunación o retrasar el embarazo debido a la vacunación (20).
Lactancia.
- No existen datos o son limitados sobre el uso de las vacunas del grupo ChAdOx1-S en mujeres lactando o sobre los efectos en los niños amamantados (20).
- No se puede excluir el riesgo para los recién nacidos/lactantes alimentados al seno. Se desconoce si las vacunas del grupo ChAdOx1-S se excreta en la leche materna.
- La lactancia materna ofrece importantes beneficios para la salud de las mujeres lactantes y de sus hijos amamantados. Se espera que la eficacia de la vacuna sea similar en mujeres lactantes que en otros adultos.
- Como las vacunas del grupo ChAdOx1-S no se replican (es decir, que no produce nuevas partículas de virus), es poco probable que represente un riesgo para el niño que recibe seno materno (20). Sobre la base de estas consideraciones, a una mujer lactante que forme parte de un grupo recomendado para la vacunación, por ejemplo, los trabajadores de la salud, se le debe ofrecer la vacuna. La OMS recomienda continuar la lactancia materna después de la vacunación (10).
Consideraciones para la vacunación de adultos mayores (edad. 65 años)
Hubo pocas personas mayores de 65 años reclutadas para los ensayos clínicos. Sin embargo, la respuesta inmunitaria inducida por la vacuna está bien documentada y es similar a las de otros grupos de edad. Teniendo en cuenta la totalidad de la evidencia disponible, la OMS recomienda la vacuna para su uso en personas de 65 años o más (10).
Efectos sobre la capacidad para conducir y utilizar máquinas
Las vacunas del grupo ChAdOx1-S tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas pueden afectar temporalmente la capacidad para conducir o utilizar máquinas.
Reacciones adversas esperadas
- Según el resumen de perfil de seguridad de las vacunas del grupo ChAdOx1-S, se basa en un análisis intermedio de datos combinados de los ensayos clínicos realizados en el Reino Unido, Brasil y Sudáfrica (15).
- Las reacciones adversas notificadas con más frecuencia fueron sensibilidad en el lugar de la inyección (63,7%), dolor en el lugar de la inyección (54,2%), dolor de cabeza (52,6%), fatiga (53,1%), mialgia (44,0%), malestar (44,2%), pirexia (incluye fiebre (33,6%) y fiebre > 38 °C (7,9%)), escalofríos (31,9%), artralgias (26,4%) y náuseas (21,9%) (8).
- La mayoría de las reacciones adversas fueron de gravedad leve a moderada y, por lo general, se resolvieron a los pocos días de la vacunación. En comparación con la primera dosis, las reacciones adversas notificadas después de la segunda dosis fueron más leves y menos frecuentes.
- Se presentaron 175 eventos adversos graves (84 en el grupo que recibió la vacuna y 91 en el grupo control). Tres eventos posiblemente estuvieron relacionados con la intervención: el primero corresponde a una mielitis transversa que se produjo 14 días después de una vacuna de refuerzo que se consideró de etiología idiopática; el segundo: una anemia hemolítica en un receptor del grupo control, y el tercero presentó fiebre superior a 40 °C dos días después de la primera dosis, se recuperó y recibió la segunda dosis sin reacción. Dos casos adicionales de mielitis transversa se consideraron poco probables relacionados con la intervención: uno 10 días después de la primera dosis de la vacuna que se atribuyó a esclerosis múltiple preexistente no diagnosticada y otro se presentó en el grupo de control que ocurrió 68 días después de la vacunación. Los casos de mielitis transversa dieron como resultado una pausa temporal del ensayo que continuó después de que el comité independiente de neurólogos expertos y todos los participantes se han recuperado o se están recuperando (15,30).
- La reactogenicidad fue generalmente más leve y se informó con menos frecuencia en adultos mayores (.65 años).
- El perfil de seguridad fue consistente entre los participantes con o sin evidencia previa de infección por SARS-CoV-2 al inicio del estudio; el número de participantes seropositivos al inicio del estudio fue de 718 (3,0%) (1).
- Al tratarse de un medicamento nuevo es importante notificar cualquier acontecimiento adverso que ocurra tras la vacunación al sistema de notificación.
- Esta vacunación no interfiere con las pruebas de PCR o de detección de antígeno. Una prueba positiva IgM/IgG a la proteína S puede indicar vacunación o infección previa. Si fuera necesario valorar en una persona vacunada la evidencia de una infección previa mediante serología se deberá usar una prueba específica IgG frente a nucleocápside (19).
Sobredosis (1)
No existe un tratamiento específico para una sobredosis con las vacunas del grupo ChAdOx1-S. En caso de sobredosis, se debe controlar al individuo y proporcionarle el tratamiento sintomático según corresponda.
Vacunación segura
Antes de recibir las vacunas grupo ChAdOx1-S debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si:
- Tiene alguna alergia. Es importante indagar al usuario en dos momentos; (i) Agendamiento de cita y (ii) Firma de consentimiento informado si ha presentado reacción alérgica grave después de cualquier otra inyección de vacuna o después de que le han administrado alguna de las vacunas del grupo ChAdOx1-S en el pasado.
- Si alguna vez se ha desmayado después de una inyección con aguja.
- Tiene fiebre
- Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre).
- Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer).
- Ha recibido otra vacuna contra la COVID-19
- En caso de ser mujer en edad reproductiva preguntar:
- Está embarazada o planea quedar embarazada
- Está amamantando
Se debe recomendar a las personas que hayan recibido las vacunas del grupo ChAdOx1-S que busquen atención médica inmediata si experimentan alguno de los siguientes síntomas (15):
- Dificultad para respirar.
- Dolor en el pecho.
- Inflamación de las piernas.
- Dolor abdominal que persiste después de la vacunación.
- Cualquier persona con síntomas neurológicos.
- Dolores de cabeza intensos o persistentes que empeoran.
- Visión borrosa que se produce varios días después de la vacunación.
- Hematomas (en cualquier lugar que no sea el lugar de la inyección).
- Petequias que aparecen unos días o más después de la vacunación.
Busque atención médica urgente si presenta síntomas de una reacción alérgica grave. Estas reacciones pueden incluir una combinación de cualquiera de los siguientes síntomas: sensación de desmayo o mareo, cambios en los latidos del corazón, dificultad para respirar, sibilancias, inflamación de labios, cara o garganta, ronchas o sarpullido, náuseas o vómitos, dolor de estómago.
Verifique si el usuario solicita su segunda dosis: evaluar el carné de vacunación y si no lo trae, proceda a verificar en el PAIWEB el tipo de vacuna que se aplicó en su primera dosis, antes de pasarlo al paso de ruta de la aplicación de la vacuna.
Nota: Ver ítem contraindicaciones y las advertencias y precauciones especiales del empleo de esta vacuna.
Vigilancia de eventos supuestamente atribuidos a vacunación o inmunización (ESAVI)
Para cumplir con los lineamientos de vacunación segura con esta vacuna, como con cualquiera de las otras incluidas en el esquema nacional, se deberá garantizar la notificación y seguimiento a las reacciones adversas que se presenten en la población después de la administración, tomando como referencia el protocolo de vigilancia en Salud Pública de los ESAVI GRAVE - Código 298 del Instituto Nacional de Salud disponible en el siguiente enlace: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
Se debe socializar la ficha de notificación de eventos adversos seguidos a la vacunación o inmunización ESAVI (ficha 298) con todas las IPS, ESE y equipos de vacunadores para su adecuado diligenciamiento y entrega a los supervisores directos. Disponible en: https://www.ins.gov.co/buscador-eventos/Lineamientos/298_EAPV_2021.pdf
Para efectos de la vigilancia en salud pública, los eventos que deberían ser notificados son aquellos que cumplen con la definición operativa de caso: Persona que presenta cualquier signo, síntoma, trastorno o síndrome después de la administración de una vacuna, que cause una incapacidad, discapacidad, ponga en riesgo la vida, requiera hospitalización u ocasione la muerte, o genere clúster de eventos graves y que, la persona, sus cuidadores o los trabajadores de la salud consideren que podría atribuirse a la vacunación o proceso de inmunización (32).
Los casos deben ser ingresados mediante la ficha de notificación de eventos adversos seguidos a la vacunación o inmunización ESAVI (ficha 298).
Fuentes de información
1. European Medicines Agency (EMA). Vaxzevria (COVID-19 Vaccine AstraZeneca). Guía Técnica. 2021;(January 29):1–34.
2. Ura T, Okuda K, Shimada M. Developments in viral vector-based vaccines. Vaccines. 2014;2(3):624–41.
3. Prüâ BM. Current state of the first covid-19 vaccines. Vaccines. 2021;9(1):1–12.
4. Tan WG, Jin H-T, West EE, Penaloza-MacMaster P, Wieland A, Zilliox MJ, et al. Comparative Analysis of Simian Immunodeficiency Virus Gag-Specific Effector and Memory CD8 + T Cells Induced by Different Adenovirus Vectors. J Virol. 2013;87(3):1359–72.
5. COVID-19: the green book chapter 14a. Coronavirus (COVID-19) vaccination information for public health professionals. Public Health England.
6. Poland GA, Ovsyannikova IG, Kennedy RB. SARS-CoV-2 immunity: review and applications to phase 3 vaccine candidates. Lancet [Internet]. 2020;396(10262):1595–606. Available from: http://dx.doi.org/10.1016/S0140-6736(20)32137-1
7. Krammer F. SARS-CoV-2 vaccines in development. Nature [Internet]. 2020;586(7830):516– 27. Available from: http://dx.doi.org/10.1038/s41586-020-2798-3
8. Invima. Resolucion 2021005436 del 23 de febrero de2021. Por la cual se otroga la ASUE para la vacuna AZD1222 del Laboratorio AstraZeneca.pdf y Resolución No. 2021038171 del 3 de Septiembre de 2021 por la cual se modifica el ASUE 2021005436 del 23 de febrero de2021.
9. Voysey M, Ann S, Clemens C, Madhi SA, Weckx LY, Folegatti PM, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. N Engl J Med. 2020;1–13.
10. World Health Organization (WHO). Interim recommendations for use of the AZD1222 ( ChAdOx1-S [ recombinant ]) vaccine against COVID- 19 developed by Oxford University and AstraZeneca. 2021;1222(February):1–7.
11. Serum Institute of India. ChAdOx1 nCoV- 19 Corona Virus Vaccine (Recombinant). 2021;3:18– 9.
12. World Health Organization. Considerations for optimizing deployment of ChAdOx1-S [recombinant] vaccines in a timelimited constrained supply situation (AstraZeneca/AZD1222- Vaxzevria, AstraZeneca/SK Bioscience and SII/Covishield vaccines). 2021; Available from: https://www.who.int/publications/m/item/considerations-for-optimizing-deployment-of-astrazeneca-azd1222-and-sii-covishield-vaccines-in-a-time-limited-constrained-supply-situation
13. World Health Organization. Interim recommendations for use of the ChAdOx1-S [recombinant] vaccine against COVID-19 (AstraZeneca COVID-19 vaccine AZD1222, SII Covishield, SK Bioscience) Update 21 April 2021. 2021;19(Interim guidance):1–8.
14. ECDC Technical Report. Overview of EU/EEA country recommendations on COVID-19 vaccination with Vaxzevria, and a scoping review of evidence to guide decision-making Key messages Background Vaccine roll-out in the EU/EEA. (May). Available from: https://www.ecdc.europa.eu/en/publications-data/overview-eueea-country-recommendations-covid-19-vaccination-vaxzevria-and-scoping
15. Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397(10269):99–111.
16. World Health Organization. Interim recommendations for use of the AZD1222 (ChAdOx1-S [recombinant]) vaccine against COVID- 19 developed by Oxford University and AstraZeneca. 2021;1222(February):1–7.
17. World Health Organization (WHO). Interim recommendations for use of the ChAdOx1-S [recombinant] vaccine against COVID-19 (AstraZeneca COVID-19 vaccine AZD1222, SII Covishield, SK Bioscience). 2021;2(Abril 23 2021):1–23.
18. Voysey M, Costa Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. Lancet. 2021;397(10277):881–91.
19. Consejo Interterritorial. Sistema Nacional de Salud. Vaxzevria. COVID-19 Vaccine AstraZeneca [Internet]. España; 2021. 1–10 p. Available from: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/ docs/Guia_Tecnica_AstraZeneca.pdf
20. World Health Organization. COVID-19 Vaccine Explainer COVID-19 Vaccine ChAdOx1-S [recombinant], Developed by Oxford University and AstraZeneca. 2021;(26 February):1–6.
21. Gov.UK. Summary of the Public Assessment Report for AstraZeneca COVID-19 vaccine - GOV.UK. 2021;1–22. Available from: WHO/2019- nCoV/vaccines/SAGE_recommendation/AZD1222/2021.2
22. Invima. Estado sobre el reporte de eventos adversos presuntamente asociados al uso de la vacuna contra covid-19 desarrollada por AstraZeneca [Internet]. 7 de abril. 2021 [cited 2021 Apr 30]. Available from: https://www.invima.gov.co/web/guest/estado-sobre-el-reporte-de-eventos-adversos-presuntamente-asociados-al-uso-de-la-vacuna-contra-covid-19- desarrollada-por-astrazeneca?redirect=%2Fweb%2Fguest%2Fnoticias-2021
23. Wise RP, Bonhoeffer J, Beeler J, Donato H, Downie P, Matthews D et al. Thrombocytopenia: case definition and guidelines for collection, analysis, and presentation of immunization safety data. Vaccine [Internet]. 2007;1(25):31. Available from: www.ncbi.nlm.nih.gov/pubmed/17493712
24. Group. BCTW. Draft Case Definition of Thrombosis and Thromboembolism. Available from: brightoncollaboration.us/draft-case-definition-ofthrombosis-and-thromboembolism/
25. Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA ES. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med [Internet]. Available from: www.ncbi.nlm.nih.gov/pubmed/33835769
26. Scully M, Singh D, Lown R, Poles A, Solomon T, Levi M et al. Pathologic Antibodies to Platelet Factor 4 after ChAdOx1 nCoV-19 Vaccination. N Engl J Med. 16 April 2021. N Engl J Med [Internet]. Available from: https://www.ncbi.nlm.nih.gov/pubmed/33861525
27. Schultz NH, Sorvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. 2021; Available from: www.ncbi.nlm.nih.gov/pubmed/33835768
28. World Health Organization. Consideraciones sobre los eventos trombóticos posteriores a la administración de la vacuna de AstraZeneca contra COVID-19 en Europa, 7 de abril. 2021; Available from: https://www.paho.org/es/documentos/consideraciones-sobre-eventos-tromboticos-supuestamente-atribuibles-administracion
29. World Health Organization. Statement of the WHO Global Advisory Committee on Vaccine Safety (GACVS) subcommittee on safety signals related to the AstraZeneca COVID-19 vaccine. 2021;(March):19–21.
30. Knoll MD, Wonodi C. Oxford–AstraZeneca COVID-19 vaccine efficacy. Lancet. 2021;397(10269):72–4.
31. Salud Canadá Gobierno de Canadá. Vacuna AstraZeneca contra COVID-19 y COVISHIELD: Riesgo de trombosis con trombocitopenia. Available from: https://canadiensensante.gc.ca/recall-alert-rappel-avis/hc-sc/2021/75211a-fra.php
32. Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. [Internet]. 2021. Available from: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA MODERNA RNAM-1273 CONTRA EL COVID-19.
Generalidades de la vacuna
La vacuna elaborada por Switzerland GMBH contra la COVID-19 denominada Moderna ARNm-1273 es ARN mensajero monocatenario producido mediante transcripción in vitro acelular, que codifica la proteína de la espícula (S) viral del SARS-CoV-2.
La vacuna estimula las defensas naturales (sistema inmunitario) y funciona haciendo que el organismo genere protección (anticuerpos) contra el virus que causa la COVID-19. Utiliza el ARNm para transportar las instrucciones con las cuales las células producen la proteína de espículas que se encuentra en el virus. Luego, las células del sistema inmunitario son estimuladas para fabricar anticuerpos contra la proteína de las espículas para luchar contra el virus y proteger a la persona vacunada contra la COVID-19 (2).
La vacuna contiene los siguientes excipientes: lípido SM-102, colesterol, 1,2-diestearoil-sn-glicero-3- fosfocolina (DSPC), 1,2-dimiristoil-rac-glicero-3-metoxipolietilenglicol-2000 (PEG2000 DMG), trometamol, clorhidrato de trometamol, ácido acético, acetato de sodio trihidrato, sacarosa, agua para preparaciones inyectables.
Presentación, forma farmacéutica e indicación terapéutica
Presentación:
- Caja por 10 viales multidosis, las cuales pueden venir con las siguientes dosis:
- Vial multidosis con un contenido de 10 dosis de 0,5 ml.
- Vial multidosis con un contenido máximo de 11 dosis: Rango de 10 a 11 dosis (0,5ml cada una).
- Vial multidosis con un contenido máximo de 15 dosis: Rango de 13 a 15 dosis (0,5ml cada una).
- Una dosis (0,5 ml) contiene 100 microgramos de ARN mensajero (ARNm) (encapsulado en nanopartículas lipídicas SM-102).
Forma farmacéutica:
- Concentrado dispersión inyectable.
- La vacuna es un líquido de color blanco o blanquecino (pH: 7,0 – 8,0) tanto en el vial como en la jeringa.
Indicaciones terapéuticas:
- Inmunización activa para prevenir la COVID-19 causado por el virus del SARS-CoV-2, en personas de 12 años o más. Esta vacuna debe utilizarse conforme a las recomendaciones del fabricante.
Conservación
Periodo de validez..
- Vial sin abrir.
| - Conservada congelada entre -25 °C y -15 °C tiene una duración de 7 meses. - Una vez descongelada, la vacuna no se debe volver a congelar. - Se debe mantener la cadena de frío y evitar la exposición de los viales a la luz solar y ultravioleta. - La vacuna debe descongelarse antes de su administración. - Después de descongelar, se pueden extraer 10 o máximo 11 o 15 dosis (0,5 ml cada una) de acuerdo con la presentación de cada vial. |  |
| - Los viales de la vacuna sin abrir pueden almacenarse refrigerados entre de +2 °C a +8 °C, protegida de la luz, durante un máximo de 30 días antes de retirar la primera dosis. Dentro de este periodo, se puede transportar durante 12 horas. |  |
Vial perforado
| - Una vez extraída la primera dosis, la vacuna tiene una estabilidad química y física en uso demostrada entre 2 ºC y 25 °C durante las 6 horas siguientes de la primera perforación y debe desecharse después de este tiempo de apertura. - Desde un punto de vista microbiológico, el medicamento debe utilizarse de inmediato. Si la vacuna no se utiliza inmediatamente, los tiempos y las condiciones de conservación durante el uso son responsabilidad del usuario. |  |
Nota: La estabilidad química y física en uso ha sido demostrada durante 19 horas entre 2°C y 25 ºC después de la primera perforación (dentro del periodo de uso permitido de 30 días entre 2ºC y 8ºC y de 24 horas entre 8ºC y 25ºC).
Eficacia
Se ha demostrado que la vacuna ARNm-1273 contra COVID-19 desarrollada por Moderna tiene una eficacia del 94,1%, según una mediana de seguimiento de dos meses. Se mantuvo una alta eficacia en todos los grupos de edad (mayores de 18 años) y no se vio afectada por el sexo o la etnia. Los datos revisados por la OMS en este momento respaldan la conclusión de que los beneficios conocidos y potenciales del ARNm-1273 superan los riesgos conocidos y potenciales (4–6).
La eficacia frente a la COVID-19 severa fue del 100% (IC=95%).
Dosis, vía, y sitio de administración (6,7)
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del |
| 2ªdosis 28 días a 84 días (12 semanas) después de aplicada la primera dosis | brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. | ||
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Administración (6,7, 8).
- La serie de vacunas de Moderna ARNm-1273 consta de dos dosis administradas por vía intramuscular cada una de 0,5 ml, con un intervalo de 28 a 84 días.
- No se debe programar que las personas reciban la segunda dosis antes de los 28 días recomendados; sin embargo, las segundas dosis administradas dentro de un período de gracia de 4 días antes de la fecha recomendada para la segunda dosis aún se consideran válidas.
- La vacuna no debe mezclarse en la misma jeringa con otras vacunas u otros medicamentos.
- El fabricante no ha evaluado la seguridad o eficacia de la vacuna de Moderna ARNm-1273 fuera de los intervalos evaluados en el estudio de fase III.
- El fabricante no sugiere ni recomienda el uso de la vacuna Moderna RNAm-1273 de cualquier otra manera que no sea la descrita en documento regulatorio aprobado localmente
- Si no es posible cumplir con el intervalo recomendado y es inevitable un retraso en la vacunación, la segunda dosis de la vacuna de MODERNA se puede administrar con un intervalo de 84 días entre primera y segunda dosis.
- Aplicar una dosis de la vacuna producida por el laboratorio MODERNA a población de 12 a 49 años que haya sido diagnosticada con infección por SARS-CoV-2 a través de pruebas de PCR o antígeno en un tiempo menor a 9 meses y que no tengan inmunosupresión ni las comorbilidades listadas en el numeral 8.2. "Administración en personas con situaciones especiales" del Anexo 1 de esta resolución.
- Se debe mantener el esquema de 2 dosis de vacuna producida por el laboratorio MODERNA, en personas con inmunosupresión, de 50 años o más, con las comorbilidades listadas en el numeral 8.2. "Administración en personas con situaciones especiales" del Anexo 1 de esta resolución y quienes han tenido la infección por SARS-CoV-2 confirmada hace 9 meses o más.
- La población de 12 a 49 años sin comorbilidades se aplicará la segunda dosis de vacuna con un intervalo de 12 semanas (84 días). En los casos en los que la persona requiera esta puede ser aplicada en un intervalo no menor a 28 días de la primera dosis.
- La población de 12 a 49 años con comorbilidades se aplicará la segunda dosis de vacuna con un intervalo de 28 días.
- Los errores de administración de vacunas deben informarse al sistema de notificación (ver vigilancia de ESAVI).
Si no es posible cumplir con el intervalo recomendado y es inevitable un retraso en la vacunación, la segunda dosis de las vacunas MODERNA debe administrarse lo más pronto posible.
Intercambiabilidad (6,8).
- La información de que se dispone sobre la intercambiabilidad de la vacuna Moderna RNAm- 1273 con otras vacunas de ARNm u otras plataformas de vacuna COVID-19 para completar la serie de vacunación es limitada a la fecha. La vacunación con esquemas heterólogos (productos diferentes en cada dosis del esquema) debe limitarse a personas con inmunosupresión (descritas en el numeral 8.2.).
- Se recomienda que ambas dosis de la serie deben completarse con el mismo producto.
- En situaciones excepcionales en las que el producto de la vacuna de ARNm administrado para la primera dosis no se puede determinar o ya no está disponible, se puede administrar cualquier vacuna de ARNm COVID-19 disponible en un intervalo mínimo de 28 días entre dosis para completar la serie de vacuna de ARNm COVID-19.
- Si se administran dos dosis de diferentes productos de la vacuna de ARNm COVID-19 en estas situaciones (o inadvertidamente), no se recomiendan dosis adicionales de ninguno de los productos en este momento. Estas personas se consideran completamente vacunadas contra COVID-19. 2 semanas después de recibir la segunda dosis de una vacuna de ARNm.
Coadministración con otras vacunas.
- No hay datos que permitan evaluar la administración concomitante de la vacuna de Moderna ARNm-1273 con otras vacunas.
- Se desconoce si la reactogenicidad de la vacuna COVID-19 aumenta con la coadministración, incluso con otras vacunas que se sabe que son más reactogénicas.
- Si bien los estudios de coadministración están en curso, según el CDC, las vacunas COVID-19 y otras vacunas ahora se pueden administrar al mismo tiempo. Esto incluye la administración simultánea de vacunas COVID-19 y otras vacunas el mismo día, así como dentro de los 14 días.
- Si la vacuna de Moderna ARNm-1273 se administra simultáneamente con otras vacunas inyectables, estas deben administrarse en diferentes sitios de inyección.
- No mezcle la vacuna de Moderna ARNm-1273 con ninguna otra vacuna en la misma jeringa.
Preparación de la vacuna
Procedimiento para la descongelación de la vacuna.
- El vial multidosis se almacena congelado y debe descongelarse antes de su uso.
- La caja térmica de Moderna ARN-m 1273 contiene 10 viales multidosis de vacuna congelados (10 dosis o máximo 11 o 15 dosis cada uno, según presentación).
- Una vez abierta, descongelar los viales introduciéndolos al refrigerador para descongelarlos a una temperatura de +2°C a +8°C, alrededor de 2 horas y 30 minutos o dejar el vial 1 hora a temperatura ambiente (entre 15°C y 25 °C).
- Antes de administrar la vacuna dejar el vial a temperatura ambiente durante 15 minutos y marcar el vial con la fecha y hora de descongelación (Nota: NO descongelar los viales desde el día anterior).
Procedimiento para la administración de la vacuna.
- La vacuna debe ser administrada por un profesional sanitario mediante técnicas asépticas para garantizar la esterilidad del procedimiento.
- Inicialmente realice lavado o higiene de manos.
- La vacuna está lista para usarse una vez descongelada.
- Verifique que el líquido tiene un color blanco o blanquecino tanto en el vial como en la jeringa.
- La vacuna puede contener partículas blancas o transparentes relacionadas con el producto.
- Gire el vial suavemente después de la descongelación y antes de cada extracción. No agitar ni sacudir.
- Una vez descongelado el vial de la vacuna se pueden extraer las dosis correspondientes de acuerdo con la presentación del vial. Ver el título de "Presentación, forma farmacéutica e indicación terapéutica" de este anexo.
- Una vez descongelado el vial de la vacuna NO volver a congelar.
- Extraiga la dosis de 0,5 ml de vacuna con una aguja y una jeringa estériles de 1ml (22G o 23G) convencional o auto descartable según disponibilidad y deseche cualquier vacuna no utilizada dentro de las 19 horas posteriores a la extracción de la primera dosis.
- Si la dosis es incorrecta, o hay un cambio de color y otras partículas presentes, no se debe administrar la vacuna.
- Se incluye un sobrellenado adicional en cada vial para garantizar que puedan administrarse 10 dosis de 0,5 ml. No acumule el exceso de vacuna de múltiples viales.
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
1. Reporte al coordinador del punto de vacunación su hallazgo.
2. No utilice el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal, por correo electrónico indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal y/o departamental/distrital.
6. El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin
7. El Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
8. Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
- Al finalizar la jornada diaria se deben identificar las dosis sobrantes por inasistencia de personas a las citas o disminución del cálculo de la pérdida por frasco abierto.
- Posteriormente, identificar la población que no se encuentre vacunada y aplicar la vacuna priorizando según fase y etapa en la cual se está desarrollando la vacunación. Si es el caso, usar la(s) dosis en personas incluidas en la siguiente etapa.
- Es importante mencionar que todas las personas a vacunar estén agendadas o no, deben seguir todo el proceso de vacunación, que incluye entre otros, diligenciar y firmar del consentimiento informado, recibir la información relacionada con la vacuna, permanecer el tiempo asignado en las instalaciones posterior a la vacunación según su condición, registrar la información en el PAIWEB y recibir el carné de vacunas.
Técnica para aplicar la vacuna.
- Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
- Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
- Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
- Con una mano estire la piel con los dedos pulgar e índice.
- Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
- Introduzca la aguja por vía intramuscular.
- Presione el émbolo para que penetre la vacuna.
- Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
- Estire la piel para perder la luz del orificio que dejó la aguja.
- Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
Observación post-vacunación
Durante el estudio clínico se informaron reacciones de hipersensibilidad en el 1,5% del grupo que recibió la vacuna y el 1,1% de los participantes del grupo que recibió el placebo (4). Sin embargo, debido a algunas reacciones alérgicas presentadas posterior al inicio de la vacunación, el fabricante recomienda que las personas vacunadas permanezcan en observación.
- Indicar a la persona vacunada, que debe permanecer en observación:
30 minutos: personas con antecedentes de una reacción alérgica inmediata de cualquier gravedad a una vacuna o terapia inyectable y personas con antecedentes de anafilaxia por cualquier causa.
15 minutos: todas las demás personas.
- En esta área, el personal de salud debe informarle los cuidados post-vacunación que se deben tener.
- Si durante su estancia en el área de observación, la persona vacunada presenta alguna molestia de tipo alérgico ya sea leve o de mayor magnitud, se contará con personal de salud capacitado para su atención y/o una ambulancia con equipo y personal idóneo; en caso de requerir tratamiento adicional, le trasladarán a una unidad de salud previamente identificada para la debida atención.
- Al terminar la estancia en el área de observación, se le entregará el carné de vacunación donde se indicará la fecha en que se aplicó la primera dosis de la vacuna y el día en que deberá acudir para la segunda dosis.
Contraindicaciones.
- Un historial de anafilaxia a cualquier componente de la vacuna es una contraindicación para la vacunación.
- La vacuna Moderna RNAm-1273 no debe administrarse a personas con antecedentes de anafilaxia al polietilenglicol (PEG), uno de los componentes de la vacuna.
- Si se produce anafilaxia después de la primera dosis, no se debe administrar una segunda dosis de la vacuna ARNm-1273 o de ARNm-BNT162b2 (Pfizer).
Precauciones.
- Un historial de anafilaxia a cualquier otra vacuna o terapia inyectable (es decir, vacunas o terapias intramusculares, intravenosas o subcutáneas) se considera una precaución, pero no una contraindicación para la vacunación. Para estas personas, un profesional de la salud con experiencia especializada en trastornos alérgicos debe realizar una evaluación de riesgos. Estas personas aún pueden recibir la vacuna. Aún es incierto si existe un mayor riesgo de anafilaxia, pero deben ser asesorados sobre el riesgo potencial de anafilaxia y los riesgos deben sopesarse con los beneficios de la vacunación. Estas personas deben ser observadas durante 30 minutos después de la vacunación en entornos de atención médica donde la anafilaxia se puede tratar de inmediato.
- Las personas con una reacción alérgica no anafiláctica inmediata, definida esta como signo o síntoma, como urticaria, angioedema o síntomas respiratorios sin ningún otro síntoma (tos, sibilancias, estridor), que se presente dentro de las 4 horas posteriores a la administración de la primera dosis no deben recibir dosis adicionales, a menos que se recomiende después de una revisión por parte de un profesional de la salud con experiencia especializada. Sin embargo, sujeto a la evaluación individual de riesgo-beneficio, el ARNm-1273 podría proporcionarse bajo una estrecha supervisión médica si es la única opción disponible para personas con alto riesgo de COVID-19 grave.
- Se ha informado de un pequeño número de reacciones anafilácticas en vacunados sin antecedentes de anafilaxia. Por lo anterior, la OMS recomienda que la vacuna ARNm-1273 se administre solo en entornos donde se pueda tratar la anafilaxia. Hasta disponer de más datos y conocimientos con respecto a la anafilaxia después de la vacunación con ARNm-1273, todos los vacunados deben ser observados durante al menos 15 minutos después de la vacunación.
- Los alimentos, el veneno de insectos, las alergias por contacto, la rinitis alérgica, el eccema y el asma no se consideran una precaución. Los tapones de los viales no están hechos con látex de caucho natural y no hay contraindicaciones ni precauciones para la vacunación de personas con alergia al látex. Además, como el ARNm-1273 no contiene huevos ni gelatina, no existe ninguna contraindicación o precaución para la vacunación de personas con alergia a cualquier sustancia alimentaria.
- Cualquier persona con una enfermedad febril aguda (temperatura corporal superior a 38,5°C) debe posponer la vacunación hasta que esté afebril.
- Ver la evaluación según el riesgo en la siguiente tabla.
Tabla. Evaluación de personas candidatas a la vacunación frente a COVID-19 de Moderna
Fuente: Dirección General de Salud Pública (Consejería de Sanidad) (9)
Advertencias y precauciones especiales de empleo (1,10)
Trazabilidad
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
- Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
- Se pueden producir reacciones relacionadas con ansiedad, incluidas reacciones vasovagales (síncope), hiperventilación o reacciones relacionadas con estrés, asociadas al acto vacunal como respuesta psicógena a la inyección con aguja. Es importante tomar precauciones para evitar lesiones a causa de un desmayo.
- La vacunación se debe posponer en personas que presenten una enfermedad febril aguda grave o una infección aguda. La presencia de una infección leve y/o de fiebre de baja intensidad no debe posponer la vacunación.
- Como sucede con otras inyecciones intramusculares, la vacuna debe administrarse con precaución a las personas que reciban tratamiento anticoagulante o a aquellas que presenten trombocitopenia o padezcan un trastorno de la coagulación (como hemofilia) debido a que en estas personas se puede producir sangrado o formación de hematomas tras una administración intramuscular.
- No se ha evaluado la eficacia, la seguridad ni la inmunogenicidad de la vacuna en personas inmunodeprimidas, incluidas aquellas que estén recibiendo tratamiento inmunosupresor. La eficacia de la vacuna puede ser menor en personas inmunodeprimidas.
- Se desconoce la duración de la protección proporcionada por la vacuna, ya que todavía se está determinando en ensayos clínicos en curso.
- Las personas pueden no estar totalmente protegidas hasta 14 días después de la segunda dosis. Como con cualquier vacuna, la vacunación con Moderna ARNm-1273 puede no proteger a todas las personas que la reciban.
- No se dispone de datos sobre la seguridad y eficacia del ARNm-1273 en personas con afecciones autoinmunes, aunque estas personas fueron elegibles para la inscripción en los ensayos clínicos. Las personas con enfermedades autoinmunes que no tienen contraindicaciones para la vacunación pueden vacunarse.
- Las personas inmunodeprimidas, incluidas las personas que reciben terapia inmunosupresora, pueden tener una respuesta inmunitaria disminuida a la vacuna. No hay datos disponibles sobre el uso concomitante con inmunosupresores.
- Personas con inmunosupresión severa por cualquier causa (incluye personas con VIH no controlado), pueden vacunarse, aunque la respuesta inmunológica por su estado podría no garantizar la eficacia demostrada de la vacuna.
- Debido a que en los ensayos de Fase III, no fueron incluidos, no se tiene información sobre la vacunación de mujeres embarazadas por lo que por ahora esta población no será incluida en la vacunación contra COVID-19.
Vacunación de poblaciones específicas (6)
Poblaciones para las que se dispone de datos de apoyo de ensayos clínicos de fase 2/3
Personas mayores.
- El riesgo de COVID-19 severo y muerte aumenta abruptamente con la edad. Los datos del ensayo de fase 3 indican que la eficacia y la seguridad de la vacuna son comparables en todos los grupos de edad (mayores de 18 años).
- Se recomienda la vacunación para las personas mayores sin un límite de edad. Los estudios de efectividad de la vacuna posteriores a la introducción han demostrado una alta efectividad y buenos perfiles de seguridad en este grupo de edad.
Personas con comorbilidades.
- Se han identificado ciertas comorbilidades que aumentan el riesgo de enfermedad grave por COVID-19 y muerte. El ensayo clínico de fase 3 demostró que la vacuna tiene perfiles de seguridad y eficacia similares en personas con diversas afecciones médicas subyacentes, incluidas aquellas que las ponen en mayor riesgo de COVID-19 grave. Las comorbilidades estudiadas en el ensayo clínico de fase 3 incluyeron enfermedad pulmonar crónica, enfermedad cardíaca significativa, obesidad grave, diabetes, enfermedad hepática e infección por el virus de la inmunodeficiencia humana (VIH).
Poblaciones para las que existen datos limitados o nulos del ensayo clínico de fase 3
Mujeres embarazadas.
- La experiencia con el uso de la vacuna COVID-19 VACCINE Moderna en mujeres embarazadas es limitada. Los estudios realizados en animales no sugieren efectos perjudiciales directos ni indirectos con respecto al embarazo, el desarrollo embriofetal, el parto o el desarrollo posnatal.
- Los estudios de toxicología reproductiva y del desarrollo completados en animales no han mostrado efectos nocivos de la vacuna durante el embarazo.
- Actualmente no se dispone de datos de ensayos clínicos sobre seguridad e inmunogenicidad en el embarazo. Hasta el momento, los datos de farmacovigilancia de la vacuna posteriores a la introducción no han identificado ningún problema agudo de seguridad, con un perfil de reactogenicidad y eventos adversos similar al informado en ausencia de embarazo.
Personas que viven con el VIH
- Las personas que viven con el VIH pueden tener un mayor riesgo de contraer COVID-19 grave.
- La vacuna no es un virus vivo, las personas que viven con el VIH que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
- Las personas VIH positivas que están bien controladas con terapia antirretroviral de gran actividad son parte de un grupo recomendado para la vacunación.
- Los datos disponibles sobre la administración de la vacuna son actualmente insuficientes para permitir la evaluación de la eficacia o seguridad de esta frente a las personas que viven con el VIH que no están bien controladas con la terapia. Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede alterar su eficacia.
- Se debe proporcionar información y, cuando sea posible, asesoramiento sobre los perfiles de eficacia y seguridad de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y beneficios. No es necesario realizar una prueba de infección por VIH antes de la administración de la vacuna.
Personas inmunodeprimidas.
- Las personas inmunodeprimidas tienen un mayor riesgo de contraer COVID-19 grave.
- Actualmente, los datos disponibles son insuficientes para evaluar la eficacia de la vacuna o los riesgos asociados a la vacuna en personas gravemente inmunodeprimidas.
- Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede alterar su eficacia.
- La vacuna no es un virus vivo, las personas inmunodeprimidas que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
- Se debe proporcionar información y, cuando sea posible, asesoramiento sobre los perfiles de eficacia y seguridad de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y los beneficios.
Personas que han tenido previamente una infección por SARS-CoV-2
- No se recomiendan las pruebas virales o serológicas para detectar una infección previa con el fin de tomar decisiones sobre la vacunación.
- Los datos de los análisis combinados indican que la vacuna es segura en personas con evidencia de infección previa por SARS-CoV-2.
- Las personas con antecedente de COVID-19 confirmado, en el marco del Plan Nacional de Vacunación contra el COVID-19 serán vacunadas treinta (30) días contados a partir del inicio de síntomas en personas sintomáticas y treinta (30) días después de la toma de muestra en personas asintomáticas.
Personas con COVID-19 agudo actual.
- Las personas con COVID-19 aguda confirmada por PCR no deben vacunarse hasta que se hayan recuperado de la enfermedad aguda y se hayan cumplido los criterios para la interrupción del aislamiento. Aún no se conoce el intervalo óptimo entre una infección natural y la vacunación.
Personas que previamente recibieron terapia con anticuerpos pasivos para COVID-19.
- Actualmente no hay datos sobre la seguridad o eficacia de la vacunación en personas que recibieron anticuerpos monoclonales o plasma de convalecencia como parte del tratamiento con COVID-19.
- La vacunación debe posponerse durante al menos 90 días para evitar la interferencia del tratamiento con anticuerpos con las respuestas inmunitarias inducidas por la vacuna.
Reacciones adversas esperadas (4,7).
- Según el resumen del perfil de los estudios de seguridad de la vacuna Moderna ARNm-1273, las reacciones adversas notificadas con más frecuencia fueron tanto las locales como las sistémicas; más con la segunda dosis: dolor en el lugar de la inyección (92%), fatiga (70%), cefalea (64,7%), mialgia (61,5%), artralgia (46,4%), escalofríos (45,4%), náuseas/vómitos (23%), hinchazón/sensibilidad axilar (19,8%), fiebre (15,5%), edema en el lugar de la inyección (14,7%) y enrojecimiento (10%). Las reacciones adversas fueron, por lo general, de intensidad leve o moderada y se resolvieron entre 4 y 5 días después de la vacunación, donde se enrolaron participantes mayores de 18 años. En las personas de mayor edad se asoció a una frecuencia ligeramente menor de acontecimientos de reactogenicidad.
- En adolescentes de 12 a 17 años dolor en el lugar de la inyección (97 %), dolor de cabeza (78 %), fatiga (75 %), mialgia (54 %), escalofríos (49 %), hinchazón/sensibilidad axilar (35 %), artralgia (35 %), náuseas/vómitos (29 %), hinchazón en el lugar de la inyección (28 %), eritema en el lugar de la inyección (26 %) y fiebre (14 %).
- La frecuencia de eventos adversos de grado 3 en el grupo de placebo (1,3%) fue similar a la del grupo de vacuna (1,5%), al igual que las frecuencias de eventos adversos atendidos médicamente (9,7% frente a 9,0%) y eventos adversos graves (0,6% en ambos grupos).
- Se informaron reacciones de hipersensibilidad en el 1,5% y el 1,1% de los participantes en los grupos de vacuna y placebo, respectivamente.
- Parálisis de Bell se produjo en el grupo de la vacuna (3 participantes (<0,1%)) y el grupo de placebo (1 participante (<0,1%)) durante el período de observación del ensayo (más de 28 días después de la inyección).
- En general, el 0,5% de los participantes en el grupo de placebo y el 0,3% en el grupo de ARNm- 1273 tuvieron eventos adversos que provocaron que no recibieran la segunda dosis, y menos del 0,1% de los participantes de ambos grupos interrumpieron su participación en el ensayo por eventos adversos después de cualquier dosis.
- No se observó evidencia de enfermedad respiratoria aumentada asociada a la vacuna.
- Se observaron menos casos de Covid-19 grave o cualquier Covid-19 entre los participantes que recibieron ARNm-1273 que entre los que recibieron placebo. Los eventos adversos que el equipo del ensayo consideró que estaban relacionados con la vacuna o el placebo se informaron entre el 4,5% de los participantes en el grupo de placebo y 8,2% en el grupo ARNm-1273.
Sobredosis
No se han notificado casos de sobredosis. En caso de sobredosis, se recomienda vigilar las funciones vitales y un posible tratamiento sintomático.
Interacción con otros medicamentos y otras formas de interacción.
- No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna de ARNm-1273 con otras vacunas.
- No mezclar la vacuna ARNm-1273 con otras vacunas / productos en la misma jeringa.
Efectos sobre la capacidad para conducir y utilizar máquinas
La vacuna Moderna ARNm-1273 tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas pueden afectar temporalmente a la capacidad para conducir o utilizar máquinas.
Vacunación segura
Antes de recibir la vacuna Moderna ARNm-1273 debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si usted:
- Tiene alguna alergia. Es importante indagar al usuario en dos momentos; (i) Agendamiento de cita y (ii) Firma de consentimiento informado si ha presentado reacción alérgica grave.
- Si alguna vez se ha desmayado después de una inyección con aguja.
- Tiene fiebre.
- Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre).
- Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer).
- Ha recibido otra vacuna contra la COVID-19.
- En caso de ser mujer en edad reproductiva preguntar:
- Está embarazada o planea quedar embarazada
- Está amamantando.
- Ha recibido otra vacuna contra el COVID-19
Nota: Ver ítem contraindicaciones.
Vigilancia de eventos supuestamente atribuidos a vacunación o inmunización (ESAVI)
Para cumplir con los lineamientos de vacunación segura con esta vacuna, como con cualquiera de las otras incluidas en el esquema nacional, se deberá garantizar la notificación y seguimiento a las reacciones adversas que se presenten en la población después de la administración, tomando como referencia el protocolo de vigilancia en salud pública de los ESAVI GRAVE - Código 298 del Instituto Nacional de Salud disponible en el siguiente enlace: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
Se debe socializar la ficha de notificación de eventos adversos seguidos a la vacunación o inmunización ESAVI (ficha 298) con todas las IPS, ESE y equipos de vacunadores para su adecuado diligenciamiento y entrega a los supervisores directos. Disponible en: https://www.ins.gov.co/buscador-eventos/Lineamientos/298_EAPV_2021.pdf Es importante mencionar que, para efectos de la vigilancia en salud pública, los eventos que deberían ser notificados son aquellos que cumplen con la definición operativa de caso: Persona que presenta cualquier signo, síntoma, trastorno o síndrome después de la administración de una vacuna, que cause una incapacidad, discapacidad, ponga en riesgo la vida, requiera hospitalización u ocasione la muerte, o genere clúster de eventos graves y que, la persona, sus cuidadores o los trabajadores de la salud consideren que podría atribuirse a la vacunación o proceso de inmunización (13).
Los casos deben ser ingresados mediante la ficha de notificación de eventos adversos seguidos a la vacunación o inmunización ESAVI (ficha 298).
Adicionalmente, reportar cualquier Evento Adverso leve posterior a la vacunación directamente al programa de farmacovigilancia de su institución, para que los mismos realicen el reporte al Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) (7).
Referencias
1. European Medicines Agency (EMA). Ficha técnica o resumen de las características del producto COVID-19 Vaccine Moderna. 2021;1–27.
2. Wang F, Kream RM, Stefano GB. An evidence based perspective on mRNA-SARS-CoV-2 Vaccine Development. Med Sci Monit. 2020;26:1–8.
3. European Medicines Agency (EMA). COVID-19 Vaccine Moderna Posología y administración.:1–2. Available from: https://www.modernacovid19global.com/eu/es/storage-handling-dosage-admin.pdf
4. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;403–16.
5. World Health Organization. Interim recommendations for use of the Moderna mRNA-1273 vaccine against COVID-19. 2021;(January):1–8. Available from: https://apps.who.int/iris/bitstream/handle/10665/338862/WHO-2019-nCoV-vaccines- SAGE_recommendation-mRNA-1273-2021.1-eng.pdf?sequence=1&isAllowed=y
6. World Health Organization. Interim recommendations for use of the Moderna mRNA-1273 vaccine against COVID-19. Update 15 June. World Heal Organ [Internet]. 2021;1–11. Available from: WHO/2019-nCoV/vaccines/SAGE_recommendation/BNT162b2/2021.1
7. Invima. Resolución No. 2021025857 de 25 de Junio de 2021. Autorización Sanitaria de Uso de Emergencia (ASUE) para la COVID-19 Vaccine Moderna Switzerland GMBH. 2021;1–20
8. Centers for Disease Control Prevention. Interim Clinical Considerations for Use of mRNA COVID- 19 Vaccines Currently Authorized in the United States [Internet]. 2021 [cited 2021 Jan 18]. Available from: https://www.cdc.gov/vaccines/covid-19/info-by-product/clinical-considerations.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fvaccines%2Fcovid- 19%2Finfo-by-product%2Fpfizer%2Fclinical-considerations.html#Administration
9. Dirección General de Salud Pública (Consejería de Sanidad). Anexo 2. Vacuna COVID-19 ARNm, Moderna. Comunidad de Madrid. 2021;1–9.
10. Food and Drug Administration. Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (EUA) of The moderna COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19). 2020;1–22. Available from: https://search.bvsalud.org/global-literature-on-novel-coronavirus-2019-ncov/resource/en/grc- 740221
11. Gray KJ, Bordt EA, Atyeo C, Deriso E, Akinwunmi B, Young N, et al. Coronavirus disease 2019 vaccine response in pregnant and lactating women: a cohort study. Am J Obstet Gynecol [Internet]. 2021;1–17. Available from: https://doi.org/10.1016/j.ajog.2021.03.023
12. Collier AY, McMahan K, Yu J, Tostanoski LH, Aguayo R, Ansel J, et al. Immunogenicity of COVID- 19 mRNA Vaccines in Pregnant and Lactating Women. 2021 [cited 2021 Jun 29]; Available from: https://jamanetwork.com/
13. Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. [Internet]. 2021. Available from: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf










